Questões Militares Sobre engenharia química e química industrial
Foram encontradas 255 questões
O refluxo é usado, com mais generalidade, na extração em fase líquida e na destilação, embora o seu princípio seja aplicável a qualquer operação multiestágio em contracorrente. Analise a figura abaixo.

( ) O refluxo apresentado na figura é raramente usado na destilação, pois requer a adição de uma corrente de vapor extra Vn+1. Usa-se o refluxo simples, ocasionalmente, quando se quer separar água de um componente mais volátil; então a corrente Vn+1 é constituída por vapor de água.
( ) O número de estágios de equilíbrio necessários para uma dada separação pode ser calculado por Δ = L0 + Vi= LnVn+1
( ) Um balanço total de massa em toda a cascata é F = V0 + D + LN + VN+i.
( ) Na extração líquido-líquido, o refluxo do extrato (L0) pode ser empregado para se ter maior recuperação do soluto no extrato. Neste caso, o solvente é removido de Vi, no separador de solvente (C), para produzir o líquido (Lc) com uma concentração baixa de solvente, parte do qual é o extrato produto (D) e outra parte é o extrato refluxo (L0).
I. Quando F=0, o sistema é invariante.
II. Uma solução líquida de álcool em água em equilíbrio com o seu vapor possui um grau de liberdade 3.
III. A adição de um gás inerte a um sistema formado por água em equilíbrio com o seu vapor altera as características do sistema.
Está(ão) correta(s) apenas a(s) afirmativa(s)
A escolha da operação de transferência de massa a ser usada para efetuar-se a separação de uma mistura multicomposta depende da viabilidade operacional, da teoria físico-química e das questões econômicas. O porte necessário para a unidade operacional tem seu custo calculado a partir do conhecimento das limitações do equilíbrio de fase. Sobre equilíbrio de fases, analise as afirmativas.
I. Para o equilíbrio líquido-líquido, na extração em fase líquida, no caso mais simples, o soluto é dividido entre duas fases líquidas insolúveis. Os dados de equilíbrio para este caso podem ser registrados como razões entre a massa de soluto e solvente em cada uma das fases em equilíbrio.
II. A adsorção, que é a forma mais comum do estabelecimento de equilíbrio entre gás e sólido, pode ocorrer mediante mecanismos físicos e químicos. As moléculas do fluido aderem à superfície do adsorvente sólido, e fica estabelecido um equilíbrio entre o fluido adsorvido e a fase fluida restante.
III. Para o equilíbrio sólido-líquido, um estágio de equilíbrio pode ser definido como aquele em que o líquido aderente aos sólidos que saem do estágio não tem a mesma composição que o extrato líquido que sai do mesmo estágio.
Está(ão) correta(s) apenas a(s) afirmativa(s)
Reatores em batelada operando adiabaticamente são frequentemente empregados para a determinação de ordens de reação, de energias de ativação e de velocidades específicas de reações exotérmicas. Essas determinações são feitas através do monitoramento das trajetórias temperatura-tempo para diferentes condições iniciais. A respeito da operação adiabática de um reator em batelada, analise as afirmativas.
I. Equação de projeto: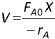
II. Balanço de energia quando o trabalho executado pelo misturador puder ser desprezado: 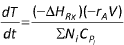
III. Para determinar o tempo necessário para obtenção de uma conversão específica: 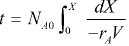
Está(ão) correta(s) apenas a(s) afirmativa(s)
Um reator em batelada é usado para operação em pequena escala, para testar novos processos que não tenham sido desenvolvidos completamente, para a fabricação de produtos caros e para processos que sejam difíceis de converter em operações contínuas. A respeito de reatores em batelada, analise as afirmativas.
I. Um reator em batelada não tem entrada nem saída de reagentes ou produtos enquanto a reação está ocorrendo.
II. O balanço geral molar resultante para a espécie j é 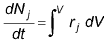 .
.
III. O reator em batelada tem a desvantagem de altas conversões que podem ser obtidas deixando o reagente no reator por longo período de tempo.
Está(ão) correta(s) apenas a(s) afirmativa(s)

I. O produto da reação L é altamente solúvel no líquido, o que o leva a não influenciar o curso do processo difusivo.
II. A concentração do gás A dissolvido é grande quando comparada à do líquido B, ou seja, A está em excesso.
III. A espécie A difunde desde a interface gás-líquido até o seu desaparecimento total ao atingir uma profundidade Z= δ na fase líquida.
Está(ão) correta(s) apenas a(s) afirmativa(s)
A melhor forma de descrever as características operacionais das bombas se faz pelo uso das curvas características. A figura abaixo mostra a relação entre a pressão de descarga (a carga da bomba, altura manométrica (H), a capacidade (Q), a eficiência (n) e a potência (P) para uma dada bomba numa velocidade de rotação).

A respeito das curvas características de uma bomba centrífuga, analise as afirmativas.
I. A pressão manométrica de descarga do fluido bombeado é dependente da densidade do fluido.
II. A pressão diminui continuamente à medida que a capacidade diminui.
III. Uma bomba centrífuga opera, usualmente, a velocidade constante, e a capacidade da bomba depende somente da pressão total, do projeto e das condições de sucção.
Está(ão) correta(s) apenas a(s) afirmativa(s)
As indústrias de processos químicos utilizam em grande medida a transferência de energia na forma de calor. De
acordo com os cálculos de projeto para trocadores de calor e a figura da taxa de transferência de calor em função
das forças motrizes, associe corretamente as colunas.

( ) O coeficiente global varia, linearmente, com T ao longo do trocador.
( ) Aplica-se ao escoamento em contracorrente.
( ) Taxa de transferência de calor.
( ) Calor cedido pelo fluido quente, quando ele passa pelo trocador de calor.
A seqüência correta é
( ) Na operação, o fluido de trabalho de uma máquina térmica absorve calor de um reservatório quente, produz uma quantidade líquida de trabalho, descarta calor para um reservatório frio e retorna ao seu estado inicial.
( ) A eficiência térmica da máquina é definida como
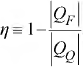
( ) Uma máquina térmica operando de forma irreversível é chamada máquina de Carnot.
( ) Para dois reservatórios de calor dados, nenhuma máquina pode possuir uma eficiência térmica inferior à de uma máquina de Carnot.
Os balanços de massa e de entalpia em torno de uma série de estágios são denominados balanços totais. Os balanços totais podem ser feitos para a cascata generalizada, em contracorrente que aparece na figura abaixo. Os símbolos L, x e h referem-se à massa, à composição e à entalpia da fase L em qualquer ponto; os símbolos V, y e H referem à massa, à composição e à entalpia da fase V.

I. Balanço de massa total: L0 - VN+1 = ∑ = LN - V1.
II. Balanço de massa de um componente: L0x0 + VN+1YN+1 = ∑Z∑ = LNxN + V1y1.
III. Balanço de energia: L0h0 + VN+1HN+1 = ∑h∑ = LNhN + V1H1
Os trocadores de calor usados pelos engenheiros químicos não podem ser caracterizados por um único modelo e,
na realidade, a variedade deste equipamento é infinita. Quando a área da troca térmica é grande, o tipo de trocador
recomendado é o de casco e tubo representado pela figura abaixo.

Sobre o trocador de calor com quatro passes nos tubos e um passe no casco, analise as afirmativas.
I. A viscosidade dos fluidos é um fator importante na escolha do fluido que deve estar no lado do casco. No casco, mediante o uso de chicanas, é possível ter uma diminuição do atrito.
II. Uma desvantagem dos trocadores de passes múltiplos é a perda extra por atrito provocada pelas velocidades mais altas e as perdas na entrada e na saída dos distribuidores.
III. A modificação constante da velocidade do fluido do casco tende a turbilhonar a corrente, o que melhora a transferência de calor.
Está(ão) correta(s) apenas a(s) afirmativa(s)
O desenvolvimento da termodinâmica é facilitado pela introdução de um tipo especial de processo em sistemas fechados, caracterizado como reversível. Sobre os processos reversíveis analise as afirmativas.
I. Atravessa uma sucessão de estados de equilíbrio.
II. Pode ser revertido em qualquer ponto por uma variação infinitesimal nas condições externas.
III. Tem atrito.
Está(ão) correta(s) apenas a(s) afirmativa(s)
Além dos reatores contínuo de tanque agitado, outro tipo de reator comumente usado na indústria é o reator tubular. Sobre os reatores tubulares, informe se as afirmativas abaixo são verdadeiras (V) ou falsas (F) e, em seguida, assinale a alternativa que apresenta a seqüência correta.
( ) Reatores tubulares são usados mais frequentemente para reações em fase líquida.
( ) Os reagentes são continuamente consumidos à medida que eles escoam ao longo do reator.
( ) É normalmente operado em estado estacionário.
A atividade dos vórtices na turbulência serve como um mecanismo para a transferência de momento. Além disso, uma vez que existem partículas grandes do fluido em movimento transversal, esta atividade turbulenta também serve como meio para a misturação física. Esta misturação física dos fluidos é importante na transferência de massa e calor. Consideremos uma fronteira numa parede que é capaz de fornecer calor ou massa a uma corrente de fluido. Se a concentração da propriedade transferível na parede for, significativamente, mais elevada que na corrente principal do fluido, haverá um gradiente nas vizinhanças da parede e ocorrerá transferência para o fluido. Depois de instalar-se o estado permanente, os gradientes de concentração nas diversas seções das correntes fluidas são os que aparecem na figura.
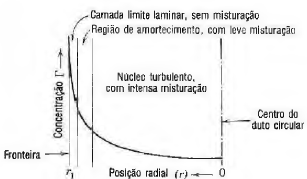
Transferência de calor e de massa no escoamento turbulento. Variação da concentração da propriedade transferida com a posição radial
Sobre a transferência de calor e massa no escoamento turbulento (figura) analise as afirmativas.
I. O gradiente na camada laminar é grande, com a maior parte da diferença de concentração entre a parede e o centro do fluido ocorrendo nesta delgada camada laminar. Nela ocorre transferência molecular, com uma taxa que depende do gradiente e da difusividade molecular.
II. O gradiente na região de amortecimento é, consideravelmente, maior que na camada laminar, com uma diferença de temperatura, ou de concentração, maior que na camada laminar.
III. O gradiente através do núcleo turbulento é muito pequeno em comparação com o da região de amortecimento. Parte da transferência ocorrerá em virtude do mecanismo de transporte molecular, mas a maior parte do transporte ocorrerá pela misturação física de massa.
Está(ão) correta(s) apenas a(s) afirmativa(s)
( ) Para o sistema absorção da amônia por água, a equação é 1/KY=1/KY; nesse caso a resistência da fase gasosa controla o processo de transferência de massa.
( ) O equipamento de separação utilizado para um sistema envolvendo um gás pouco solúvel na fase líquida são as torres spray.
( ) Utilizam-se as torres de borbulhamento quando as duas fases (líquido e gás) controlam o processo de transferência de massa ou quando se opera com elevadas taxas de vapor em relação às do líquido.
( ) Para o sistema absorção do dióxido de carbono por água, a equação é 1/KX=1/KX; nesse caso a resistência da fase líquida controla o processo de transferência de massa.
A partir da equação
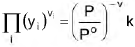 preencha as lacunas abaixo e, em seguida, assinale a alternativa correta.
Um aumento em K, a uma pressão constante, resulta em um (a)_______________ em π
i(yi)Vi isso implica um
deslocamento da reação para direita e um(a) __________ em ξ
e. Um aumento em T causa um(a)
em K e um (a)_______________ em πi(yi)vi,a uma P constante.
preencha as lacunas abaixo e, em seguida, assinale a alternativa correta.
Um aumento em K, a uma pressão constante, resulta em um (a)_______________ em π
i(yi)Vi isso implica um
deslocamento da reação para direita e um(a) __________ em ξ
e. Um aumento em T causa um(a)
em K e um (a)_______________ em πi(yi)vi,a uma P constante.
Além das técnicas de separação que se processam em contatos contínuos, existem outras que operam em estágios. A figura abaixo ilustra o contato entre as correntes leve e pesada no interior de uma coluna de estágios.
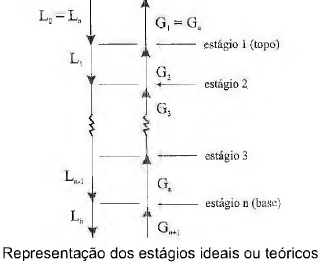
De acordo com a figura e operações em estágio, analise as afirmativas.
I. Balanço global: La + Gn+1 = L n + Ga .
II. Balanço do componente A: x Aa La + y An+i Gn+1 = x An Ln+ y Aa Ga.
III. Como exemplo de equipamentos que operam por estágios, cita-se a torre de recheio.
Está(ão) correta(s) apenas a(s) afirmativa(s)

I. Para a figura b, a transferência de quantidade de movimento se sucede em nível molecular e o regime continua sendo laminar.
II. Houve modificação qualitativa (U∞1 para U∞2), mas não quantitativa, pois não ocorreu a mistura macroscópica devido ao entrelaçamento entre as lâminas.
III. Ao regime laminar quando comparado às figuras a e b: as lâminas de fluido mais distantes da parede da placa apresentam agitação distinta se comparada com aquela associada às lâminas próximas à superfície da placa, mas o comportamento macroscópico não é afetado.
Está(ão) correta(s) apenas a(s) afirmativa(s)