Questões Militares de Química - Eletroquímica: Oxirredução, Potenciais Padrão de Redução, Pilha, Eletrólise e Leis de Faraday.
Foram encontradas 198 questões
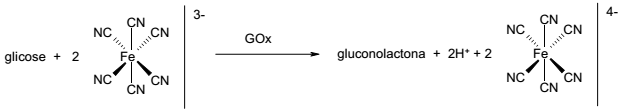
Nesse sistema de medição, faz-se reagir uma amostra contendo glicose com o íon ferricianeto ([Fe(CN)6]3- ) na presença da enzima GOx, obtendo-se como produtos gluconolactona, H+ e ferrocianeto ([Fe(CN)6]4- ). Um eletrodo de platina promove a reação de regeneração do ferricianeto, sendo que a corrente que passa por esse eletrodo é proporcional à concentração de glicose na amostra.
Com base no exposto, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) A enzima GOx catalisa a oxidação da glicose.
( ) No eletrodo de platina ocorre a redução do íon de ferro.
( ) A transformação de glicose em gluconolactona envolve 2 elétrons.
( ) O valor de pH do meio tende a diminuir no processo de detecção de glicose.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
Considere uma célula eletrolítica na forma de um tubo em H, preenchido com solução aquosa de NaNO3 e tendo eletrodos inertes mergulhados em cada ramo vertical do tubo e conectados a uma fonte externa. Num determinado instante, injeta-se uma solução aquosa de CuCrO4 verde na parte central do ramo horizontal do tubo. Após algum tempo de eletrólise, observa azul e uma amarela, separadas (em escala) de acordo com o esquema da figura.
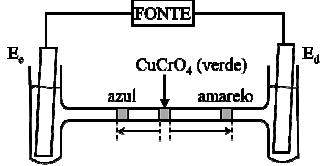
Com base nas informações do enunciado e da figura, assinale a opção ERRADA.
No estado padrão, é de 0,240 V o potencial da pilha cuja reação pode ser descrita pela seguinte equação química:
2 NO + ½ O2 + H2O → 2 HNO2.
Assinale a alternativa que apresenta o valor da energia livre padrão da reação, em kJ·mol-1.
Considere a reação descrita pela seguinte equação química:
H2(g, 1bar) + 2AgBr(s) → 2H+ (aq) + 2Br−(aq) + 2Ag(s).
Sendo X o potencial padrão (E°) da reação, o pH da solução a 25 °C quando o potencial da reação (E) for Y
será dado por