Questões Militares
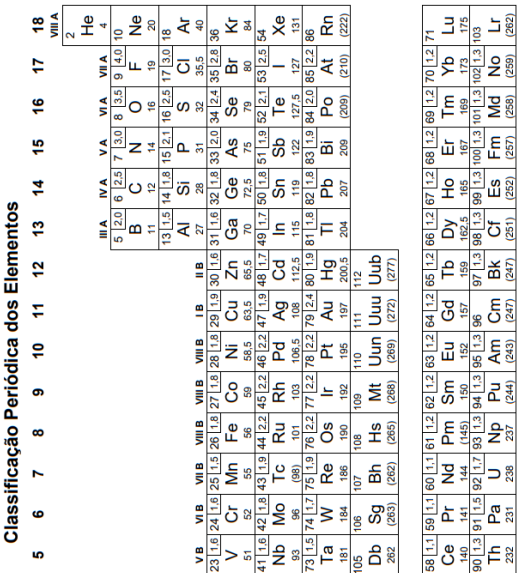
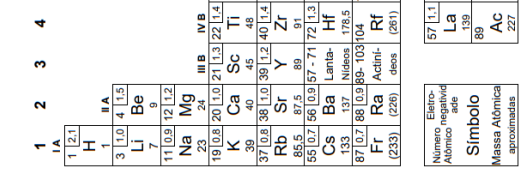
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 195 questões
Considere a seguinte representação de uma pilha.

A partir dos potenciais padrões de eletrodo fornecidos, o diagrama de célula que representa a pilha e seu potencial são:
Na zincagem de uma peça de ferro, foi utilizado um banho eletrolítico contendo 63 g.L-1 de cloreto de zinco (M = 136 g.mol-1). Sabendo que, no processo de zincagem, foram consumidos 1,93x104 C de carga e que a constante de Faraday é 9,6x104 C.mol-1, a concentração de íons zinco (M = 65 g.mol–1), em mol.L-1, do banho eletrolítico, ao final do processo, foi de aproximadamente
II. Dado que os valores de potencial padrão do eletrodo de cobre e do calomelano saturado em relação ao eletrodo padrão de hidrogênio são, respectivamente, 0,34 V e 0,24 V, o potencial do eletrodo de cobre em relação ao eletrodo de calomelano saturado será 0,10 V.
III. Os potenciais padrão de eletrodo não são valores absolutos de semicélulas, mas sim diferenças de potencial entre semicélulas.
IV. O catodo de uma célula galvânica torna-se o anodo quando essa célula passa a operar como célula eletrolítica, embora a redução sempre ocorra no catodo da célula e a oxidação sempre ocorra no anodo.
Assinale a opção que contém as afirmações CORRETAS.
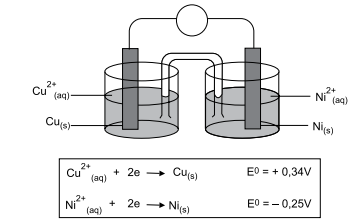
Considerando a constante de Faraday igual a 9,65 × 104 C.mol–1 , a energia livre de Gibbs para essa pilha é
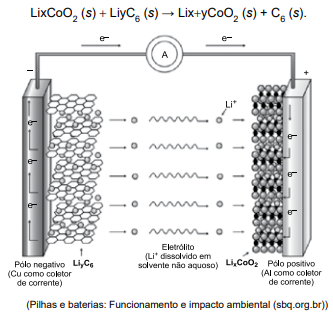
De acordo com o esquema, durante a descarga da bateria
MnO4 – (aq) + H2 O2 (aq) + H+ (aq) → Mn2+ (aq) + O2 (g) + H2 O(l)
Considerando as semirreações e seus potenciais de redução, a 25 ºC,
O2 + 2 H+ + 2 e– → H2 O2 ; E0 = + 0,68 V MnO4 – (aq) + 8 H+ (aq) + 5 e– → Mn2+(aq) + 4 H2 O(l); E0 = +1,51 V
conclui-se que o potencial da reação global e os coeficientes estequiométricos menores e inteiros que completam a equação são:
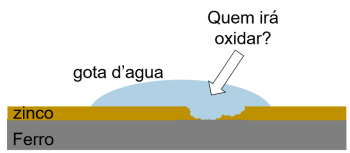
Considerando a imagem e os valores de E°red fornecidos, é CORRETO afirmar que a substância que sofrerá oxidação será:
Mg2+ + 2e–→ Mg0 E°red= –2,37 V Fe2+ + 2e–→ Fe0 E°red= –0,44 V
A partir das informações apresentadas, assinale a afirmativa correta.
Al0 + 3Ag+ → Al3+ + 3Ag0
A partir desta observação da pilha acima representada pela equação, assinale a alternativa correta.

Cu2+(aq) + 2
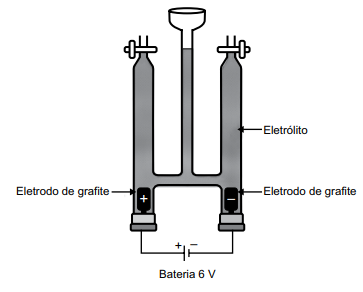
Em uma aula prática de química, foi montada a aparelhagem representada na figura a seguir, para um experimento de eletrólise, usando-se como eletrólito, uma solução aquosa de iodeto de sódio 1,0 mol/L em pH = 7 e algumas gotas de uma solução aquosa de amido.
Dados: potencial padrão de redução a 25 ºC.
O2(g) + H2O(l) + 4e–
→ 4OH–(aq) Eo
= +0,40 V
I2(s) + 2 e– → 2 I– (aq) Eo = +0,54 V
O2(g) + 4 H+(aq) + 4e– → 2 H2O(l) Eo = +1,23 V
2 H2O (l) + 2e– → H2(g) + 2OH– (aq) Eo = –0,83 V
Na+(aq) + 1e– → Na(s) Eo = –2,71 V
(P. Atkins, P.; L. Jones; Princípios de Química: questionando a vida
moderna e o meio ambiente. 5ª ed. Porto Alegre: Bookman, 2012)
Ao iniciar o experimento, verificou-se o sugimento de
coloração azulada em um dos compartimentos eletródicos e a formação de um gás no outro compartimento.
Esse fato ocorreu devido à formação de iodo no
A bateria de Thomas Edison desenvolvida no século 19 é um dispositivo eletroquímico que funciona de acordo com o esquema simplificado representado na figura. No sentido da descarga, o potencial fornecido por par de eletrodos é igual a +1,35V
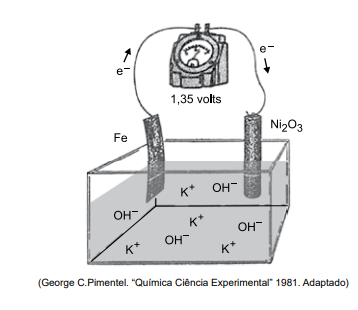
Considere as informações:
Semirreação Potencial padrão de redução (Eº)
I. Fe(OH)2 (s) + 2e– → Fe(s) + 2OH– (aq) X
II. Ni2O3(s) + 3H2O (l) + 2e– → 2Ni(OH)2(s) + 2OH–
(aq) +0,48V
Na bateria de Thomas Edison em operação no sentido da descarga, o eletrodo em que se processam a oxidação e o
potencial padrão de redução da equação I são:
Uma solução aquosa de cianeto de sódio foi adicionada a uma solução aquosa de permanganato de potássio, em meio básico. Assim, foram formados o óxido de manganês (IV) sólido e o íon cianato, CNO– .
Na semirreação envolvendo um mol do íon cianeto há a participação de ________ elétrons.
No balanceamento da equação global da reação envolvendo 2 mol do íon permanganato, participam _______ de íons hidroxila representados no lado dos _______ da equação de reação.
Assinale a alternativa que preenche, correta e respectivamente, as lacunas do texto.
a KMnO4 + b FeSO4 + c H2SO4 → d Fe2(SO4)3 + e K2SO4 + f MnSO4 + g H2O
A soma dos coeficientes estequiométricos (a + b + c + d + e + f + g) que tornam a equação balanceada é igual a

Considerando as informações apresentadas, os agentes oxidantes que corroerão somente o chumbo das peças são:
O ferro é um elemento de ampla utilização pela indústria, como a produção de ligas metálicas, de automóveis e de diversos utensílios domésticos e industriais. Esse metal pode ser obtido através de uma reação de oxirredução entre a magnetita e o monóxido de carbono, conforme representado nas equações abaixo:
I Fe3O4 + 3CO → 3FeO + 3CO2
II FeO + CO → Fe + CO2
Acerca das reações apresentadas, assinale a alternativa correta.
As reações de ustulação são processos inorgânicos que podem dar origem a produtos como metais puros e óxidos metálicos. Nessas reações, sulfetos são submetidos a uma reação de combustão conforme disposto no exemplo a seguir:
x FeS2(g) + y O2(g) → zFe3O4(s) + w SO2(g)
Os números que representam corretamente os coeficientes estequiométricos x, y, z e w são, respectivamente,
As semirreações de redução a seguir descrevem como pode ocorrer esse processo reacional:
Fe2+(aq) + 2e- → Fe(s) E0 = - 0,44 V
O2 (g) + 4H+ (aq) + 4e- → 2H2O (l) E0 = + 1,23 V
Em uma suposta pilha formada pelas duas semirreações, qual substância atuaria como agente redutor?
