Questões Militares de Química - Eletroquímica: Oxirredução, Potenciais Padrão de Redução, Pilha, Eletrólise e Leis de Faraday.
Foram encontradas 198 questões
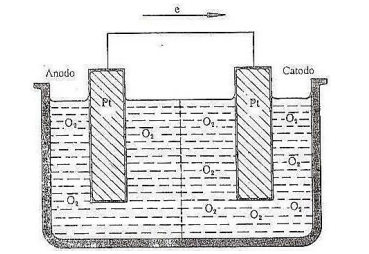 De acordo com a figura, analise as afirmativas a seguir.
I. O valor Epilha só será positivo se pO2(C) < pO2(A).
II. Admite-se que as pressões parciais do oxigênio seja 0,1 e 1 atm o Epilha é 0,01477 V.
III. Reação do anodo: 4 OH– → 2H2O + O2 (0,1 atm) + 4e.
Está(ão) correta(s) apenas a(s) afirmativa(s)
De acordo com a figura, analise as afirmativas a seguir.
I. O valor Epilha só será positivo se pO2(C) < pO2(A).
II. Admite-se que as pressões parciais do oxigênio seja 0,1 e 1 atm o Epilha é 0,01477 V.
III. Reação do anodo: 4 OH– → 2H2O + O2 (0,1 atm) + 4e.
Está(ão) correta(s) apenas a(s) afirmativa(s) CONSTANTES

DEFINIÇÕES


CONSTANTES

DEFINIÇÕES


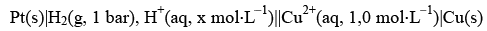
CONSTANTES

DEFINIÇÕES


I. Alumínio II. Magnésio III. Paládio IV. Sódio V. Zinco
Assinale a opção que apresenta o(s) metal(is) de sacrifício que pode(m) ser utilizado(s).
Com relação à ação corrosiva da água, coloque F (falso) ou V (verdadeiro) nas afirmativas abaixo, e assinale a opção correta.
I- O efeito do cloreto de sódio na corrosão deve-se ao fato de esse sal ser um eletrólito forte, ocasionando, portanto, aumento de condutividade.
II- O oxigênio é considerado como um fator de controle do processo corrosivo, sempre acelerando o processo, independentemente de sua concentração.
III- As reações de corrosão são, usualmente, mais rápidas em temperaturas negativas.
IV- Como a água do mar é um eletrólito forte, ocorre acentuada corrosão quando materiais metálicos diferentes são ligados e expostos à atmosfera marinha ou submersos em água do mar.
Assinale a opção que apresenta as espécies que sofrem oxidação e redução, respectivamente, na reação a seguir:
CuS(s) + o2(g) Cu(s) + So2(g)
Analise as semi-reações a seguir.
Ti = Ti+2 + 2e- E0 = +1,63 V
Sc = Sc+3 + 3e- E0 = +2,08 V
O valor da f.e.m. da pilha formada pelos elementos do
sistema acima é:
Diferentes marcas de telefones celulares buscam ganhar novos clientes, anunciando que a bateria de seus aparelhos é mais eficiente que a dos concorrentes, por manterem o telefone celular ligado por mais tempo. Quando descarregada, a bateria do celular é conectada a uma rede elétrica para que sua carga seja restabelecida.
Esse processo é um exemplo de: