Questões Militares
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 195 questões
Os processos de corrosão são considerados reações químicas heterogêneas ou reações eletroquímicas que se passam geralmente na superfície de separação entre o metal e o meio corrosivo. A caracterização da forma de corrosão auxilia bastante no esclarecimento do mecanismo e na aplicação de medidas adequadas de proteção. Relacione as formas de corrosão às suas respectivas características fundamentais e, em seguida, assinale a alternativa que apresenta a sequência correta.
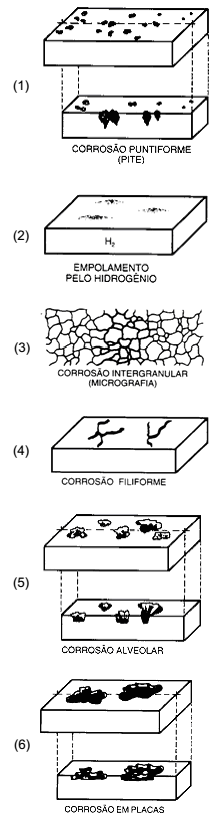
(Gentil, Vicente, 2007)
( ) a corrosão se processa entre os órgãos da rede cristalina do
material metálico.
( ) a corrosão se processa sob forma de finos filamentos, mas não profundos.
( ) o hidrogênio atômico penetra no material metálico, se transforma em hidrogênio molecular, exercendo pressão e originando a formação de bolhas.
( ) a corrosão se processa na superfície metálica produzindo sulcos ou escavações que apresentam fundo arredondado e profundidade geralmente menor que o seu diâmetro.
( ) a corrosão se processa em pontos ou pequenas áreas localizadas na superfície metálica produzindo cavidades que apresentam o fundo de forma angulosa e profundidade geralmente maior do que seu diâmetro.
( ) a corrosão se localiza em regiões da superfície metálica e não em toda sua extensão, formando placas com escavações.
“Corrosão é a deteriorização de um material, geralmente metálico, por ação química ou eletroquímica do meio ambiente aliada ou não a esforços mecânicos.” (Gentil, 1994)
Com base na afirmação, analise as figuras abaixo e, em seguida, assinale a alternativa que representa uma reação de oxi-redução eletroquímica.

II – a reação Zn2+(aq) + Cu º(s) ➞ Zn º(s) + Cu2+(aq) não é espontânea;
III – pode-se estocar, por tempo indeterminado, uma solução de nitrato de níquel II, em um recipiente revestido de zinco, sem danificá-lo, pois não haverá reação entre a solução estocada e o revestimento de zinco do recipiente;
IV – a força eletromotriz de uma pilha eletroquímica formada por chumbo e magnésio é 2,24 V;
V – uma pilha eletroquímica montada com eletrodos de cobre e prata possui a equação global: 2 Ag+ (aq) + Cuº(s) ➞ 2 Agº(s) + Cu2+ (aq) .
DADOS:
Constante de Faraday= 96500 Coulombs/mol de elétrons
Massa molar do níquel=59 g/mol
Massa molar da prata=108 g/mol

Esse conjunto de cubas em série é ligado a uma bateria
durante um certo intervalo de tempo, sendo observado
um incremento de 54 g de massa de prata em um dos
eletrodos de prata. Desse modo, o incremento da massa
de níquel em um dos eletrodos de níquel é de
Dada a seguinte equação iônica de oxidorredução da reação, usualmente utilizada em etapas de sínteses químicas, envolvendo o íon dicromato (Cr2O72-) e o ácido oxálico (H2C2O4):
Cr2O72- + H2C2O4 + H+→ + Cr3+ + CO2 + H2O
Considerando a equação acima e o balanceamento de equações químicas por oxidorredução,
a soma total dos coeficientes mínimos e inteiros obtidos das espécies envolvidas e a substância
que atua como agente redutor são, respectivamente,
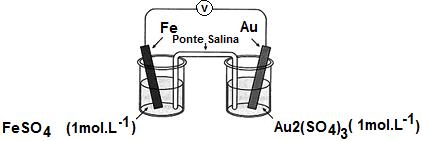
Dados:
Fe2+ (aq) + 2e ? Fe (s) E0 = - 0,44 V
Au3+ (aq) + 3e ? Au(s) E0 = + 1,50 V
Assinale a alternativa correta
Bebidas especialmente ingeridas por esportistas têm representado importante fatia de consumo. Tais bebidas são soluções isotônicas repositoras hidroeletrolíticas e, portanto, auxiliam na manutenção e preparação física de atletas de todas as modalidades. A seguir, reproduz-se parte da tabela nutricional constante no rótulo de uma dessas bebidas.

A partir dessas informações e considerando os múltiplos aspectos que
elas suscitam, julgue o item subsequente.
Por serem soluções eletrolíticas, as referidas bebidas conduzem
corrente elétrica.
Embora o peróxido de hidrogênio (H2O2) não seja considerado um radical livre, ele é responsável, direta ou indiretamente, por diversas patologias. Em termos químicos, esse óxido é fracamente reativo, porém exerce papel deletério no organismo, por ser capaz de transpor facilmente membranas celulares e gerar o radical hidroxil (•OH), seja por meio de exposição à luz ultravioleta (equação I), seja por interação com metais de transição, como o ferro, por meio do processo conhecido como reação de fenton (equação II).

Considerando as informações acima, julgue o item a seguir.
Na reação de fenton, o peróxido de hidrogênio atua como agente
oxidante.
Observe o gráfico a seguir.
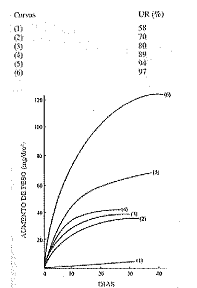
O gráfico acima evidencia a influência de deposição de partículas de NaCl em superfícies de ferro, em diferentes valores de umidade relativa.
Analisando o gráfico, é correto afirmar que
