Questões Militares
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 198 questões
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

Considere as seguintes semirreações de oxirredução e seus respectivos potenciais padrão na escala do eletrodo padrão de hidrogênio (EPH):
I. 2CO2 + 12H+ + 12e- ⇌ C2H5OH + 3H2O E°I = 0,085V
II. O2 + 4H+ + 4e- ⇌ 2H2O E°II = 1,229V
Assinale a opção que apresenta a afirmação ERRADA sobre uma célula eletroquímica em que a semirreação I ocorre no anodo e a semirreação II, no catodo.
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

Considere que a reação abaixo ocorra em uma pilha.
2 Fe+++ + Cu → Cu++ + 2 Fe++
Assinale a alternativa que indica o valor correto do potencial padrão dessa pilha.
Dados:
Fe++ → Fe+++ + e- E0 = -0,77 V
Cu++ + 2e- → Cu E0 = +0,34 V
Células galvânicas (pilhas) são dispositivos nos quais reações espontâneas de oxidorredução geram uma corrente elétrica. São dispostas pela combinação de espécies químicas com potenciais de redução diferentes. Existem milhares de células galvânicas possíveis. Considere as semirreações abaixo e seus respectivos potenciais de redução nas condições padrão (25 °C e 1 atm).
Al3+ (aq) + 3 e- → Al (s) ΔE°red = -1,66 V
Au3+ (aq) + 3 e- → Au (s) ΔE°red = +1,50 V
Cu2+ (aq) + 2 e- → Cu (s) ΔE°red = +0,34 V
Baseado nas possibilidades de combinações de células galvânicas e suas representações esquemáticas recomendadas pela União Internacional de Química Pura e Aplicada (IUPAC), são feitas as seguintes afirmativas:
I - a diferença de potencial (d.d.p.) da pilha formada pelas espécies químicas alumínio e cobre e representada esquematicamente por Al(s)|Al3+(aq)||Cu2+ (aq) |Cu (s) é de +1,52 V (nas condições-padrão);
II - na pilha formada pelas espécies químicas cobre e ouro e representada esquematicamente por Cu (s) |Cu2+(aq) || Au3+(aq) |Au (s), a reação global corretamente balanceada é:
3 Cu (s) + 2 Au3+ (aq) → 3 Cu2+ (aq) + 2 Au (s)
III - na pilha formada pelas espécies químicas cobre e ouro e representada esquematicamente por Cu (s) | Cu2+(aq) || Au3+ (aq) | Au (s), o agente redutor é o Cu (s);
IV - a representação IUPAC correta de uma pilha de alumínio e ouro (Al-Au) é Au (s) | Au3+(aq) || Al3+(aq) | Al (s).
Estão corretas apenas as afirmativas
“Um banho de ouro consiste em mergulhar o metal-base em uma solução de sais de ouro e ligá-lo à corrente elétrica. Ao lado dele, mergulha-se uma barra de ouro ligada ao outro polo de corrente elétrica, que tem, nessas condições, a propriedade de transportar o ouro líquido e depositá-lo sobre a peça a ser dourada. O banho de ouro pode ser aplicado em diversos tipos de metal-base, como: prata, níquel, cobre e latão. Dependendo do tempo de duração da imersão da peça, essa camada poderá ser mais ou menos espessa. A boa douração tem espessura na ordem de 0,02 mm ou 20 mícrons.”
(Disponível em: https://agatarp.com.br/blog/2012/08/31/a-diferenca-entre-folheamento-e-o-banho-de-ouro/.)
Assinale a alternativa que corresponde ao número de mols de ouro utilizado em uma eletrodeposição de Au+ que durou 7 minutos e utilizou 4,6 A.
(Dados: massa molar do Au = 197g; 1F = 96500C; 1A = 1C/s.)
Analise as afirmativas a seguir.
I. Quanto maior o potencial de redução, maior o poder da espécie química de se reduzir.
II. Em uma reação química de oxidação-redução espontânea, o melhor oxidante reage com o melhor redutor.
III. Em uma reação espontânea, a variação do potencial é sempre em módulo.
IV. A equação da oxidação-redução que ocorre para o eletrodo de hidrogênio pode ser escrita como semirreação de redução ou semirreação de oxidação.
Estão corretas as afirmativas
Bebidas especialmente ingeridas por esportistas têm representado importante fatia de consumo. Tais bebidas são soluções isotônicas repositoras hidroeletrolíticas e, portanto, auxiliam na manutenção e preparação física de atletas de todas as modalidades. A seguir, reproduz-se parte da tabela nutricional constante no rótulo de uma dessas bebidas.

A partir dessas informações e considerando os múltiplos aspectos que
elas suscitam, julgue o item subsequente.
Por serem soluções eletrolíticas, as referidas bebidas conduzem
corrente elétrica.
Embora o peróxido de hidrogênio (H2O2) não seja considerado um radical livre, ele é responsável, direta ou indiretamente, por diversas patologias. Em termos químicos, esse óxido é fracamente reativo, porém exerce papel deletério no organismo, por ser capaz de transpor facilmente membranas celulares e gerar o radical hidroxil (•OH), seja por meio de exposição à luz ultravioleta (equação I), seja por interação com metais de transição, como o ferro, por meio do processo conhecido como reação de fenton (equação II).

Considerando as informações acima, julgue o item a seguir.
Na reação de fenton, o peróxido de hidrogênio atua como agente
oxidante.
A Equação de Nernst, desenvolvida pelo químico e físico alemão Walther Hermann Nernst, é a relação quantitativa que permite calcular a força eletromotriz de uma pilha para concentrações de íons diferentes de uma unidade. Também é usada para cálculos em titulação de oxidação-redução.
A equação a 25°C pode ser escrita de forma reduzida como: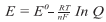
Sendo: R = 8,315 J K-1 mol-1; T = 298,2 K (25°C); F = 96485 C mol-1
Calcule a força eletromotriz para a seguinte pilha a 25°C: Fe / Fe2 + (0,02M) || Cu2
+(0,2M) / Cu
Dados: potencial padrão de redução (Eº Fe = -0,44V e Eº Cu = +0,40V).
Corrosão é a destruição ou deterioração de um material devido à reação química ou eletroquímica com seu meio. A corrosão é a transformação de um material pela sua interação química ou eletroquímica com o meio.
Sobre os exemplos de métodos de combate à corrosão, é incorreto afirmar que
Inibidor de corrosão é uma substância ou mistura de substâncias que, quando presente em concentrações adequadas, no meio corrosivo, reduz ou elimina a corrosão. As seguintes afirmativas referem-se ao inibidor de corrosão.
I. Inibidores protetivos emulsionáveis em água deixam por evaporação uma película oleosa aplicada por diluição em água.
II. O método de proteção usando protetivos temporários é baseado na obtenção de uma película superficial, fácil de aplicar e remover.
III. Inibidores catódicos têm a capacidade de formar películas sobre as áreas anódicas e catódicas, interferindo com a ação eletroquímica.
IV. Inibidores anódicos atuam favorecendo as reações anódicas, protegendo o cátodo da corrosão. São eficazes, mesmos em pequenas concentrações.
Está correto apenas o que se afirma em
A afirmativa a seguir contextualiza a questão. Leia‐a atentamente.
“A corrosão é a deterioração de um material, geralmente metálico, por ação química ou eletroquímica do meio ambiente associada ou não a esforços mecânicos.”
(GENTIL, V. corrosão. LTC. 6ª ed. 2012.)
Nem sempre é possível, nem de interesse, ter as concentrações iônicas a 1M ou atividade unitária, por isso se utiliza certa equação para poder fazer o cálculo da determinação dos novos potenciais. Esta equação foi desenvolvida por qual cientista?2 H₂O + O₂ + 4 e⁻ ↔ 4OH⁻ E° = +0,401 V
Sendo P₀₂ catodo e P₀₂ anodo as pressões parciais do oxigênio no catodo e no anodo respectivamente, é correto afirmar que o potencial da pilha é:
Em uma placa de ferro limpa foi gotejado cerca de 0,5 mL de solução aquosa a 3% de NaCl contendo alguns miligramas de K3Fe(CN)6 e fenolftaleína. Decorridos alguns minutos, foi observado o aspecto esquematizado na figura a seguir. Parte central azulada e ao redor coloração róseo-avermelhada.
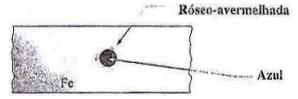
Sobre o enunciado e a figura, analise as afirmativas a seguir.
I. A parte central da gota é catódica, pois o ferro foi reduzido dando Fe2+ .
II. Área anódica: 4OH– → 2 H2O + O2 + 4e.
III. A pilha de aeração diferencial é formada entre áreas anódicas e catódicas pertencentes ao mesmo eletrólito.
Está(ão) correta(s) apenas a(s) afirmativa(s)
Reações de oxidação e redução podem ocorrer em muitos sistemas químicos. Exemplos incluem nosso próprio sistema respiratório e o sistema fotossintético complementar nas plantas. Além disso, podemos pensar no processo de assar o pão, no enferrujamento do ferro, na ação dos alvejantes sobre as manchas e na produção e combustão do petróleo. Nesse contexto, analise as afirmativas a seguir.
I. O ∆G° para a reação NiO2(s) + 2Cl– (aq) + 4H+ (aq) → Cl2(g) + Ni2+(aq) + 2H2O, sabendo que o potencial padrão de pilha é 0,320 V a 25°C é –30,9 kJ.
II. 0,395 g de cobre são depositados no catodo de uma célula eletrolítica se uma corrente elétrica de 2,00 A passa por uma solução de CuSO4 por um período de 20 min.
III. Na eletrólise de solução aquosa de cloreto de sódio forma-se gás cloro no ânodo e gás hidrogênio no cátodo.
Está(ão) correta(s) apenas a(s) afirmativa(s)