Questões Militares
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 192 questões
Quando um material sofre corrosão, é importante avaliar a composição desse material, o meio corrosivo e sob quais condições operacionais ele ficou exposto. De acordo com o tipo de material e o meio corrosivo, a corrosão pode ser química ou eletroquímica.
Associe corretamente o mecanismo de corrosão ao(s) respectivo(s) processo(s) de corrosão.
MECANISMOS DE CORROSÃO
(1) Químico
(2) Eletroquímico
PROCESSOS DE CORROSÃO
( ) Ataque da borracha por ozônio.
( ) Oxidação do ferro exposto ao ambiente.
( ) Ataque do aço inox pelo cloro, em presença de umidade.
( ) Oxidação do aço inox por O2, em ambiente seco, formando Cr2 O3
Quando dois metais distintos (eletrodos) são imersos em uma solução condutora (eletrólito), produz-se uma célula ou uma pillha galvânica. A diferença de potencial fornecida pela célula pode ser calculada pela equação de Nernst
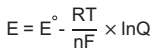
em que E é a diferença de potencial fornecida pela pilha; E" é o potencial padrão da pilha; R é a constante universal dos gases; n é o número de elétrons envolvidos na semirreação de oxidação ou redução; F é a constante de Faraday, e Q é quociente reacional, o qual fornece a razão entre as atividades dos produtos e dos reagentes envolvidos na reação global da pilha.
Com base no exposto acima, informe se é verdadeiro (V) ou falso (F) o que se afirma a seguir.
( ) Quanto maior for o tamanho da célula, maior será o potencial fornecido.
( ) Os materiais que compõem os eletrodos afetam o potencial gerado pela pilha.
( ) A concentração dos íons em solução não influencia o potencial fornecido pela pilha.
( ) A diferença de pontencial gerada pela pilha varia com a temperatura da célula e com a composição do eletrólito.
De acordo com as afirmações, a sequência correta é
Sempre que se liga um aparelho de CD portátil ou um computador portátil, completa-se um circuito que permite que uma reação química ocorra em uma bateria – uma descendente direta da pilha de Volta de metais e papel. As pilhas e baterias são exemplos de células eletroquímicas.
Considere que uma pilha hipotética de dois metais X e Y tem a seguinte representação simbólica:
X (s) / X2+ (aq) // Y2+ (aq) / Y (s)
Quantitativamente, os potenciais de redução dos eletrodos foram mensurados em valores de –1,0 V e –3,0 V.
Com base nessas informações, assinale a alternativa em que a característica dessa pilha está incorreta.
A proteção catódica é uma técnica de combate à corrosão, usada como complementar à ação protetora dos revestimentos que, por melhores e mais bem aplicados que sejam, sempre contêm falhas e poros e se tornam deficientes com o tempo. Para a obtenção da proteção catódica, dois sistemas são utilizados, ambos baseados no princípio de injeção de corrente elétrica na estrutura: proteção catódica galvânica e a proteção catódica por corrente impressa. Considerando a necessidade de instalação de anodos de zinco em uma estrutura metálica revestida e submersa em água do mar, calcule a corrente elétrica necessária para sua proteção catódica, em A (Àmpere), sabendo que a estrutura de 100 m2 está pintada com um revestimento de eficiência média igual a 90% e que se movimenta em relação à água do mar a uma velocidade de 3 m/s, e assinale a opção correta.
Dados: densidade de corrente elétrica da água do mar = 55 mA/m2.

Considerando a classificação das formas de corrosão segundo a sua morfologia, correlacione os termos técnicos a suas definições e assinale a opção que apresenta a sequência correta.
TERMOS TÉCNICOS
I- Intergranular
II- Dezincificação
III- Empolamento pelo hidrogênio
IV- Transgranular
V- Filiforme
DEFINIÇÕES
( ) A corrosão se processa nos grãos da rede cristalina do material metálico, o qual, perdendo suas propriedades mecânicas, poderá fraturar à menor solicitação mecânica.
( ) É a corrosão que ocorre em ligas de latão, em que se observa o aparecimento de regiões de coloração avermelhada, contrastando com a característica coloração amarela dos latões.
( ) A corrosão se processa entre os grãos da rede
cristalina do material metálico, o qual perde suas
propriedades mecânicas e pode fraturar quando
solicitado por esforços mecânicos.
( ) A corrosão se processa sob a forma de finos filamentos, mas não profundos, que se propagam em diferentes direções e que não se ultrapassam, pois admite-se que o produto de corrosão, em estado coloidal, apresente carga positiva, daí a repulsão.
( ) Corrosão que ocorre quando o hidrogênio atômico penetra no metal e difunde-se rapidamente para regiões com descontinuidades, onde se transforma em hidrogênio molecular, exercendo pressão e originando a formação de bolhas.
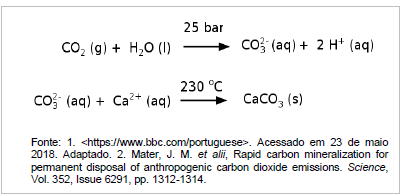
A remoção desse gás da atmosfera ocorre por:
Dados: massa molar do cobre = 64 g · mol-1 ; 1 Faraday = 96500 C · mol-1
A seguir, são apresentadas algumas semi-reações de redução e seus respectivos potenciais-padrão.
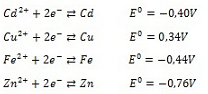
FONTE: ATKINS, P.; PAULA, J. Atkins Físico Química. 7 ed. Rio de Janeiro: LTC, 2003. v. 1. p. 336.
A partir dessas semi-reações, pode-se afirmar que
Calcule a f.e.m. de uma célula formada pela imersão de uma lâmina de cobre numa solução de 0,15M de CuSO4 e um bastão de zinco numa solução de 0,25M de ZnSO4 e marque a opção correta.
Dados:
Equação de Nernst: E = E0 + (0,0592/n) x log M
Cu2+ + 2e- = Cu; E0Cu = 0,34V
Zn2+ + 2e- = Zn; E0Zn = -0,76V
log(0,15) = -0,82391
log(0,25) = -0,60206
Analise os potenciais padrão dos eletrodos de prata e zinco abaixo.
Ag+ + e- ↔ Ag E° = + 0,7999 V
Zn2+ + 2e- ↔ Zn E° = - 0,763 V
Assinale a opção que apresenta a reação da pilha dos
potenciais padrão acima.
Calcule o potencial da célula Zn|ZnSO4||CuSO4|Cu e indique se a reação Zn(s)+ Cu2+ -> Zn2+ + Cu(s) ocorre de forma espontânea ou não, marcando a opção correta.
Dados: E0Cu = +0,337V; E0Zn = -0.763V
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

Considere as seguintes semirreações de oxirredução e seus respectivos potenciais padrão na escala do eletrodo padrão de hidrogênio (EPH):
I. 2CO2 + 12H+ + 12e- ⇌ C2H5OH + 3H2O E°I = 0,085V
II. O2 + 4H+ + 4e- ⇌ 2H2O E°II = 1,229V
Assinale a opção que apresenta a afirmação ERRADA sobre uma célula eletroquímica em que a semirreação I ocorre no anodo e a semirreação II, no catodo.
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

Considere que a reação abaixo ocorra em uma pilha.
2 Fe+++ + Cu → Cu++ + 2 Fe++
Assinale a alternativa que indica o valor correto do potencial padrão dessa pilha.
Dados:
Fe++ → Fe+++ + e- E0 = -0,77 V
Cu++ + 2e- → Cu E0 = +0,34 V
Células galvânicas (pilhas) são dispositivos nos quais reações espontâneas de oxidorredução geram uma corrente elétrica. São dispostas pela combinação de espécies químicas com potenciais de redução diferentes. Existem milhares de células galvânicas possíveis. Considere as semirreações abaixo e seus respectivos potenciais de redução nas condições padrão (25 °C e 1 atm).
Al3+ (aq) + 3 e- → Al (s) ΔE°red = -1,66 V
Au3+ (aq) + 3 e- → Au (s) ΔE°red = +1,50 V
Cu2+ (aq) + 2 e- → Cu (s) ΔE°red = +0,34 V
Baseado nas possibilidades de combinações de células galvânicas e suas representações esquemáticas recomendadas pela União Internacional de Química Pura e Aplicada (IUPAC), são feitas as seguintes afirmativas:
I - a diferença de potencial (d.d.p.) da pilha formada pelas espécies químicas alumínio e cobre e representada esquematicamente por Al(s)|Al3+(aq)||Cu2+ (aq) |Cu (s) é de +1,52 V (nas condições-padrão);
II - na pilha formada pelas espécies químicas cobre e ouro e representada esquematicamente por Cu (s) |Cu2+(aq) || Au3+(aq) |Au (s), a reação global corretamente balanceada é:
3 Cu (s) + 2 Au3+ (aq) → 3 Cu2+ (aq) + 2 Au (s)
III - na pilha formada pelas espécies químicas cobre e ouro e representada esquematicamente por Cu (s) | Cu2+(aq) || Au3+ (aq) | Au (s), o agente redutor é o Cu (s);
IV - a representação IUPAC correta de uma pilha de alumínio e ouro (Al-Au) é Au (s) | Au3+(aq) || Al3+(aq) | Al (s).
Estão corretas apenas as afirmativas