Questões Militares
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 195 questões
Com relação à limpeza de superfícies metálicas e proteção contra a corrosão, analise as afirmativas abaixo.
I - Uma das vantagens da decapagem alcalina, em relação à decapagem ácida das superfícies metálicas, é que não há possibilidade de fragilização por hidrogênio.
II - O jateamento abrasivo, apesar de ser um processo oneroso para preparo de superfícies metálicas, é um método seguro para peças de seções reduzidas e dimensões rigorosas.
III- No processo de galvanização, o aço é revestido por uma camada de zinco através da imersão do metal em banho de zinco fundido.
IV - A eletrodeposição proporciona uma camada protetora bastante fina e livre de imperfeições, sendo, portanto, recomendada para aplicação de revestimentos caros como ouro e prata.
V - Um processo frequente para proteção do alumínio é a anodização, através do qual se produz uma camada protetora de óxido por meio de oxidação eletrolítica.
Assinale a opção correta.
Coloque V (verdadeiro) ou F (falso) nas afirmativas abaixo, com relação à corrosão de metais, assinalando a seguir a opção correta.
( ) A passivação de um metal pode ser obtida por meio da oxidação ou por polarização anódica.
( ) Uma das formas de atenuar a corrosão galvânica em estruturas compostas de materiais metálicos diferentes é utilizar o metal catódico para confecção das peças pequenas e, para as peças maiores da estrutura, metal anódico .
( ) A corrosão eletrolítica pode ser diminuída se o valor da corrente elétrica de interferência for aumentado.
( ) Na zona de respingos, próxima à faixa de variação das marés, a ação corrosiva é mais acentuada devido a diversos fatores, dentre eles a salinidade da água do mar e a ação mecânica das ondas.
Analise a tabela abaixo .

Com relação aos dados contidos na tabela acima, assinale a
opção correta.
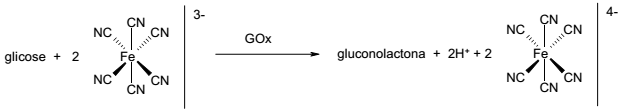
Nesse sistema de medição, faz-se reagir uma amostra contendo glicose com o íon ferricianeto ([Fe(CN)6]3- ) na presença da enzima GOx, obtendo-se como produtos gluconolactona, H+ e ferrocianeto ([Fe(CN)6]4- ). Um eletrodo de platina promove a reação de regeneração do ferricianeto, sendo que a corrente que passa por esse eletrodo é proporcional à concentração de glicose na amostra.
Com base no exposto, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) A enzima GOx catalisa a oxidação da glicose.
( ) No eletrodo de platina ocorre a redução do íon de ferro.
( ) A transformação de glicose em gluconolactona envolve 2 elétrons.
( ) O valor de pH do meio tende a diminuir no processo de detecção de glicose.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
Considere uma célula eletrolítica na forma de um tubo em H, preenchido com solução aquosa de NaNO3 e tendo eletrodos inertes mergulhados em cada ramo vertical do tubo e conectados a uma fonte externa. Num determinado instante, injeta-se uma solução aquosa de CuCrO4 verde na parte central do ramo horizontal do tubo. Após algum tempo de eletrólise, observa azul e uma amarela, separadas (em escala) de acordo com o esquema da figura.
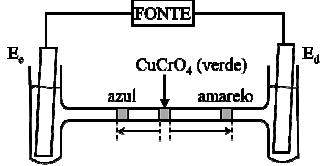
Com base nas informações do enunciado e da figura, assinale a opção ERRADA.
No estado padrão, é de 0,240 V o potencial da pilha cuja reação pode ser descrita pela seguinte equação química:
2 NO + ½ O2 + H2O → 2 HNO2.
Assinale a alternativa que apresenta o valor da energia livre padrão da reação, em kJ·mol-1.
Considere a reação descrita pela seguinte equação química:
H2(g, 1bar) + 2AgBr(s) → 2H+ (aq) + 2Br−(aq) + 2Ag(s).
Sendo X o potencial padrão (E°) da reação, o pH da solução a 25 °C quando o potencial da reação (E) for Y
será dado por
( ) No meio não aerado, o hidrogênio pode ficar adsorvido na superfície do catodo, polarizando a pilha formada com conseqüente redução do processo corrosivo.
( ) Se o oxigênio puder ser rápido e uniformemente fornecido a uma superfície metálica, é possível reparar fraturas que ocorram na película, diminuindo-se, assim, a velocidade de corrosão.
( ) O cobre tem uma velocidade de corrosão rápida em presença de ácidos não oxidantes, e em presença de oxigênio este vai funcionar como estimulador de corrosão.
( ) A corrosão eletroquímica será tanto mais intensa quanto maior o valor do pH.
( ) O cobre se mostra eficaz quando disperso em resina, geralmente epóxi, ou em silicatos inorgânicos ou orgânicos.
( ) No mecanismo de barreira, a eficiência da proteção depende da espessura do revestimento e da resistência das tintas ao meio corrosivo.
( ) No mecanismo de inibição, as tintas de fundo contêm determinados pigmentos inibidores que dão origem à formação de uma camada passiva sobre a superfície do metal, impedindo a sua passagem para a forma iônica.
Diferentes marcas de telefones celulares buscam ganhar novos clientes, anunciando que a bateria de seus aparelhos é mais eficiente que a dos concorrentes, por manterem o telefone celular ligado por mais tempo. Quando descarregada, a bateria do celular é conectada a uma rede elétrica para que sua carga seja restabelecida.
Esse processo é um exemplo de:
Observe a reação de oxirredução não balanceada a seguir.
Cu(s) + Ag+(aq) → Ag(s) + Cu2+(aq)
A soma de todos os coeficientes estequiométricos da reação
balanceada é :