Questões Militares
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 192 questões
Em meados do século XX, as pilhas alcalinas surgiram como uma alternativa muito mais eficiente energeticamente em comparação às pilhas tradicionais. Como mostra a seguinte figura, a pilha alcalina utiliza os mesmos eletrodos da tradicional, porém o seu eletrólito é uma solução aquosa de hidróxido de sódio concentrada (~30% em massa) contendo uma dada quantidade de óxido de zinco ― daí a denominação alcalina para essa pilha.
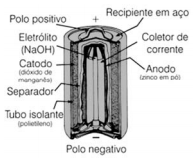
Internet:<http://qnesc.sbq.org.br> (com adaptações).
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

(1) O volume da solução de permanganato de potássio gasto na titulação foi de 100 mL. (2) O menor coeficiente estequiométrico inteiro para Fe2+ na reação redox balanceada é 7. (3) No ponto final, o volume total da solução será de 120 mL. (4) Um precipitado sólido de cor esverdeada será observado como produto dessa reação. (5) O número total de elétrons envolvidos na reação redox é 22 milimols. (6) A razão entre os volumes do titulante e do titulado no ponto final é 2,1.
A soma dos números associados às afirmações CORRETAS é igual a
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio


Sabe-se que a bateria converte Pb e PbO2 em PbSO4 na descarga e que, em condições normais, o pH da solução eletrolítica é menor que 1.
A respeito dessa bateria, foram feitas as seguintes afirmações:
I. Em condições normais, durante a descarga, a semirreação principal que ocorre no ânodo é a i e, no cátodo, é a iv. II. Em condições normais, o potencial da bateria no equilíbrio pode ser representado por E = 1,93 − 0,06pH + 0,06log
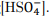 III. Em condições padrão, a eletrólise da água sempre acontece.
IV. Em pH ∼ 2, os potenciais das semirreações secundárias igualam-se aos potenciais das semirreações
principais do ânodo e do cátodo, respectivamente, portanto a eletrólise da água não ocorre
quando o eletrólito tem pH > 2.
III. Em condições padrão, a eletrólise da água sempre acontece.
IV. Em pH ∼ 2, os potenciais das semirreações secundárias igualam-se aos potenciais das semirreações
principais do ânodo e do cátodo, respectivamente, portanto a eletrólise da água não ocorre
quando o eletrólito tem pH > 2. Considerando apenas argumentos baseados no equilíbrio termodinâmico a 25 °C, está(ão) ERRADA(S) apenas a(s) afirmação(ões)
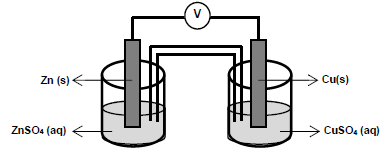
Num laboratório, um grupo de alunos possui quatro semicélulas montadas, todas em condição padrão de concentração e temperatura, correspondentes às semirreações mostradas no quadro abaixo:
Semicélula Semirreação de redução E0 / V
I MnO2 + 4H+ + 2e- → Mn2+ + 2H2O 1,23
II I2 + 2e- → 2I- 0,54
III Cu2+ + 2e- → Cu 0,34
IV Zn2+ + 2e- → Zn -0,76
Numa dada combinação para montar uma pilha eletroquímica, o valor de diferença de potencial (ΔE) da pilha, no instante em que se ligaram os contatos, foi de 0,69 V.
A combinação utilizada nessa pilha foi entre as semicélulas:
Diferentes marcas de telefones celulares buscam ganhar novos clientes, anunciando que a bateria de seus aparelhos é mais eficiente que a dos concorrentes, por manterem o telefone celular ligado por mais tempo. Quando descarregada, a bateria do celular é conectada a uma rede elétrica para que sua carga seja restabelecida.
Esse processo é um exemplo de:
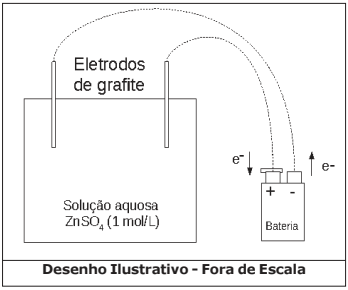
Nestes últimos anos, os alunos da EsPCEx têm realizado uma prática no laboratório de química envolvendo eletrólise com eletrodos inertes de grafite. Eles seguem um procedimento experimental conforme a descrição:
- Num béquer de capacidade 100 mL (cuba eletrolítica) coloque cerca de 50 mL de solução aquosa de sulfato de zinco (ZnSO4) de concentração 1 mol·L-1. Tome como eletrodos duas barras finas de grafite. Ligue-as com auxílio de fios a uma fonte externa de eletricidade (bateria) com corrente de 2 Ampères. Esta fonte tem capacidade para efetuar perfeitamente esse processo de eletrólise. Uma das barras deve ser ligada ao polo negativo da fonte e a outra barra ao polo positivo da fonte. Mergulhe os eletrodos na solução durante 32 minutos e 10 segundos e observe.
Considere o arranjo eletrolítico (a 25 ºC e 1 atm), conforme visto na figura a seguir:
Dados: 1 Faraday (F) = 96500 Coulomb (C) / mol de elétrons
Acerca do experimento e os conceitos químicos envolvidos são feitas as seguintes afirmativas:
I – Na superfície da barra de grafite ligada como cátodo da eletrólise ocorre a eletrodeposição do zinco metálico.
II – A semirreação de oxidação que ocorre no ânodo da eletrólise é Zn (s) → Zn2+ (aq) + 2 e- .
III – Durante o processo a barra de grafite ligada ao polo positivo da bateria se oxida.
IV – No ânodo da eletrólise ocorre uma reação de oxidação da hidroxila com formação do gás oxigênio e água.
V – A massa de zinco metálico obtida no processo de eletrólise será de 0,83 g.
Das afirmativas feitas, estão corretas apenas
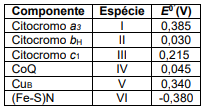
Respeitando o gradiente de energia livre, o fluxo de elétrons deve percorrer a sequência mostrada em:
Considerando a constante de Faraday 9,65 x 104 C.mol–1 , a massa máxima de níquel e ouro depositadas nesse período de funcionamento do sistema foi, respectivamente, de, aproximadamente,
2 Na+(eletrólito) + 2 e– ➝ 2 Na(l) Eº = –2,71 V S8 (l) + 16 e– ➝ 8 S2– (eletrólito) Eº = –0,51 V
O potencial padrão dessa bateria e o número de elétrons transferidos para cada molécula S8 (l), são, respectivamente,
No trecho “Quando estou com a água, não guardo mágoa. Explodo de emoção”, o autor descreve a maneira altamente energética com que sódio metálico reage com água, conforme equação a seguir:
a Na(s) + b H2O(l) c NaOH(aq) + d H2(g)
Na equação balanceada, os valores dos coeficientes estequiométricos a, b, c e d são, respectivamente:
Num laboratório, um grupo de alunos possui quatro semicélulas montadas, todas em condição padrão de concentração e temperatura, correspondentes às semirreações mostradas no quadro abaixo:

Numa dada combinação para montar uma pilha eletroquímica, o valor de diferença de potencial (ΔE) da pilha, no instante em que se ligaram os contatos, foi de 0,69 V.
A combinação utilizada nessa pilha foi entre as semicélulas:
Quando a bateria está em uso (atuando como uma pilha), o anodo corresponde ao componente:
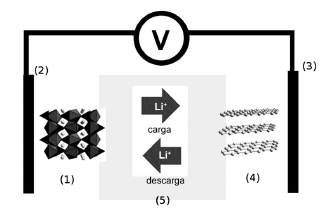
As semirreações que descrevem o processo de oxirredução estão descritas a seguir.
Cu2+ (aq) + 2e- → Cu(s) E0red = + 0,34 V (volts) Zn2+ (aq) + 2e- → Zn(s) E0red = - 0,76 V (volts)
Para o processo descrito, analise as afirmativas abaixo e dê valores Verdadeiro (V) ou Falso (F).
( ) O eletrodo de zinco sofre oxidação e o eletrodo de cobre sofre redução. ( ) A reação de oxidação ocorre no cátodo e reação de redução ocorre no ânodo. ( ) O diagrama de célula do processo é Zn (s)|Zn2+(aq)||Cu2+(aq)|Cu (s). ( ) Os elétrons fluem do ânodo para o cátodo. ( ) A reação global da pilha é Cu(s) + Zn2+(aq) → Cu2+(aq) + Zn(s) e a diferença de potencial é 1,10 V (volts).
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
O fósforo branco, substância química cuja estrutura é representada pela fórmula P4 , é utilizado em algumas munições fumígenas (munições que produzem fumaça). Ele pode ser obtido a partir da fosforita (Ca3(PO4)2), um mineral de fosfato de cálcio, por meio da reação com sílica (dióxido de silício - SiO2) e carvão coque (C) num forno especial a 1300 ºC.
A equação não balanceada da reação é:
Ca3(PO4)2 (s) + SiO2 (s) + C (s) → CaSiO3 (s) + CO (g) + P4 (s)
Acerca deste processo, são feitas as seguintes afirmativas:
I – Após o balanceamento da equação por oxidorredução, a soma dos coeficientes estequiométricos é igual a 35.
II – O dióxido de silício é uma molécula que apresenta estrutura de geometria molecular angular.
III – O agente redutor do processo é o dióxido de silício.
IV – Neste processo ocorre a oxidação do carbono.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.
Neste ano de 2019, foi realizada pelos alunos da EsPCEx uma prática no laboratório de química envolvendo eletrólise com eletrodos ativos conforme a descrição experimental:
- Num béquer de capacidade 100 mL (cuba eletrolítica) coloque cerca de 50 mL de solução aquosa de sulfato de cobre II de concentração 1 mol.L-1. Tome como eletrodos uma barra fina de cobre e um prego de ferro. Ligue-os com auxílio de fios a uma fonte externa de eletricidade com uma corrente contínua de intensidade de 3 Ampères. Esta fonte tem capacidade para efetuar perfeitamente esse processo de eletrólise. O prego deve ser ligado ao polo negativo da fonte e a barra de cobre ao polo positivo da fonte. Mergulhe os eletrodos na solução durante 16 minutos e 5 segundos e observe.
Considere o arranjo eletrolítico (a 25 ºC e 1 atm) e o sal completamente dissociado, conforme visto na figura a seguir:
Dado: 1 Faraday (F) = 96500 Coulomb (C) / mol de elétrons
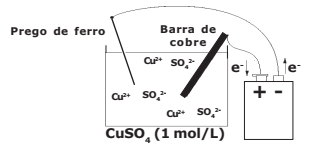
Na discussão apresentada nos relatórios dos diversos grupos de alunos, surgiram as seguintes afirmativas:
I – Na superfície do prego ocorreu a deposição de cobre metálico.
II – Durante o processo a barra de cobre se oxida.
III – A massa de cobre metálico que se depositou na superfície do prego foi de 2,45 g.
IV – A semi-reação de redução que ocorre no cátodo é Cu2+ + 2 e- → Cuº.
V – A reação global é Fe2+ + Cuº → Feº + Cu2+
Um experimento usado nas aulas práticas de laboratório da EsPCEx para compreensão da reatividade química é pautado na reação entre magnésio metálico (Mg0) e ácido clorídrico (HCl). Experimentalmente consiste em mergulhar uma fita de magnésio metálico numa solução de concentração 0,1 mol/L de ácido clorídrico. Acerca do processo acima descrito e considerando-se ocorrência de reação, são feitas as seguintes afirmativas:
I – A ocorrência da reação é evidenciada pela formação de bolhas do gás oxigênio.
II – Um dos produtos formados na reação é o óxido de magnésio.
III – O coeficiente estequiométrico do ácido clorídrico, após a escrita da equação da reação corretamente balanceada, é 2.
IV – O agente oxidante dessa reação de oxidorredução é o ácido clorídrico.
V – Considerando a solução inicial do ácido clorídrico de concentração 0,1 mol/L como 100 % ionizado (ácido forte), o pH dessa solução é 2.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima
Um analista químico realizou um experimento em que utilizou 200 mL de uma solução de concentração 2 mol/L de ácido clorídrico (HCl) para reagir com uma certa massa de bicarbonato de sódio (também denominado de hidrogenocarbonato de sódio). Notou que nem todo o ácido reagiu com essa massa de bicarbonato de sódio, restando um excesso de ácido. Ao final do experimento, ele obteve um volume de 6,15 L de gás carbônico, medidos a 27 ºC e 1 atm. Esse gás carbônico é oriundo da decomposição do ácido carbônico produzido na reação.
Dados: R = 0,082 atm·L·mol-1·K-1
T (Kelvin) = t (Celsius) + 273
Esse analista fez as seguintes afirmativas:
I – A equação química balanceada que descreve corretamente a reação citada é:
Na2CO3 + 2 HCl → H2CO3 + 2 NaCl
II – Para a formação de 6,15 L de CO2, foram consumidos 21 g de bicarbonato de sódio.
III – É uma reação de oxidorredução e o ácido clorídrico é o agente oxidante.
IV – Se todo esse ácido clorídrico fosse consumido numa reação completa com bicarbonato de sódio suficiente, o volume de gás carbônico produzido seria de 9,84 L.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.