Questões Militares
Comentadas sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 148 questões
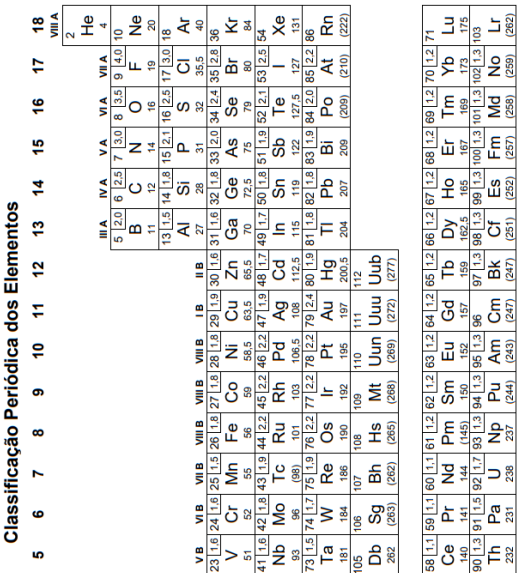
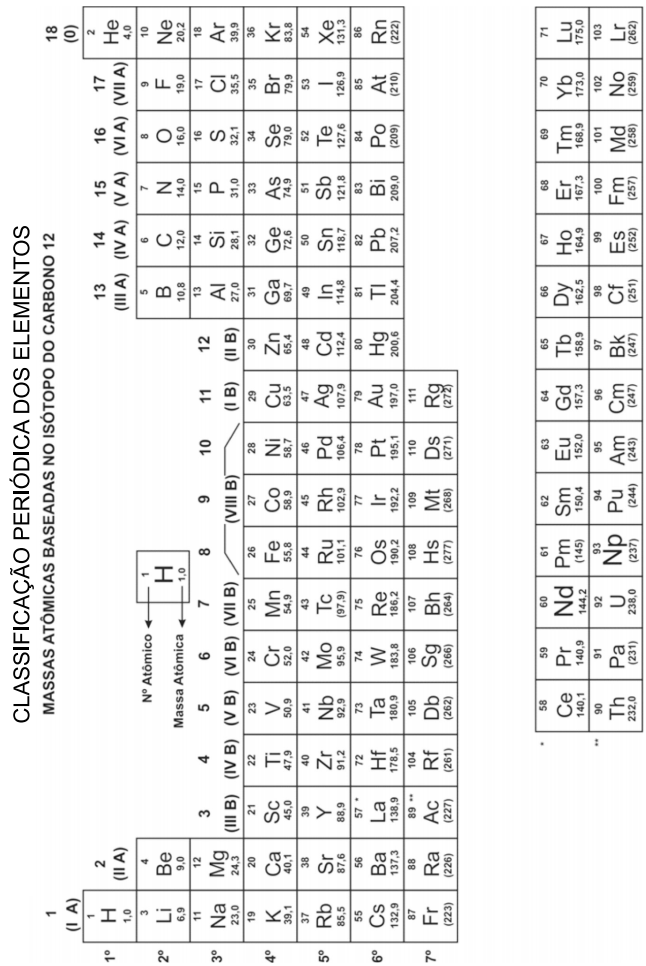
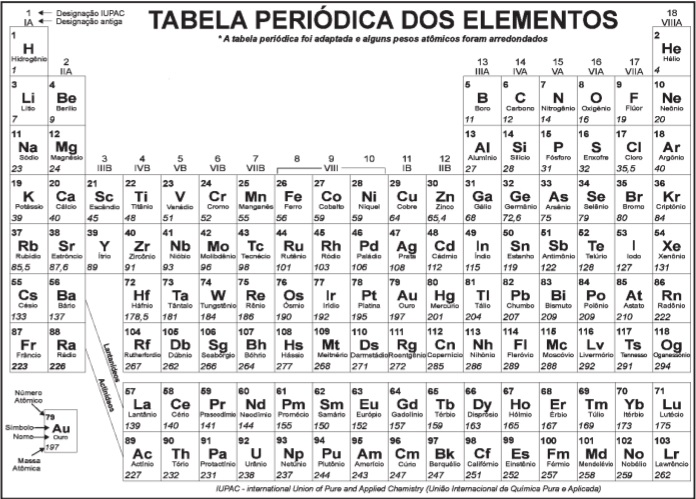
Considere as massas atômicas C: 12g mol–1, H: 1g mol–1 e O: 16gmol–1.
A massa molecular do ácido oxálico, em g mol–1, é
O RDX, explosivo de grande aplicação militar, tem a seguinte fórmula molecular:
C3H6N6O6
Assim, qual a massa de Nitrogênio em uma embalagem de 11,1 kg de RDX?
Dados: Massas atômicas: C=12,H=1,N=14 e O=16.
PO43− + 12MoO42− + 27H+ → H3PMo12O40 + 12H2O
Nesse teste, a quantidade de matéria de MoO42− necessária para uma amostra de 10 mL contendo 2 mg L−1 de H3PO4 (98 g mol−1 ) é mais próxima de:
Dados: 1 mg = 10−3 g; 1 mL = 10−3 L
O número de mols presente em uma amostra de 262g de bicarbonato de sódio (NaHCO3) é aproximadamente
Dado: Massa Molar NaHCO3 = 84g/mol
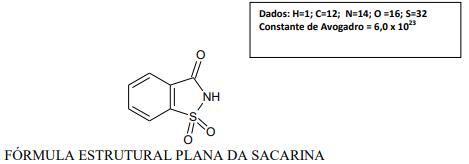
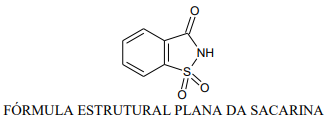
Dados: H=1; C=12; N=14; O =16; S=32 Constante de Avogadro = 6,0 x 1023
Disponível em: <http://g1.globo.com/sp/campinas-regiao/noticia/2012/05/carreta- com-produto-quimico-tomba-em-curva-de-rodovia-em-paulinia-sp.html>. Acesso em: 9 de ago. 2021 (adaptado).
O cumeno, cuja nomenclatura é isopropilbenzeno, pode ser explorado industrialmente para a produção de fenol e propanona pelo processo de oxidação descrito na equação química a seguir:
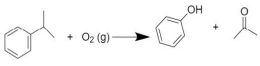
Considerando que todo o produto na carreta seja 100% puro, o qual seria completamente consumido na produção de 7,5 toneladas de fenol, qual é o valor aproximado previsto do rendimento dessa reação?
Sabe-se que a soda cáustica é o nome usual do hidróxido de sódio (NaOH), que é comercializada no estado sólido no qual, em alguns produtos disponíveis, o grau de pureza é cerca de 90% em massa. No laboratório, quando se deseja neutralizar 10 g de soda cáustica, são necessários 100 mililitros de solução de ácido clorídrico (HCl).
Com base nessas informações, qual é a concentração, em mol/L, do ácido clorídrico necessária para neutralizar completamente a soda cáustica?
Conforme descrito pelo Corpo de Bombeiros Militar de Minas Gerais, um incêndio destruiu parte de uma casa no norte do estado de Minas Gerais. O acidente ocorreu quando uma criança de 4 anos brincava com uma caixinha de fósforos.
Disponível em: https://www.otempo.com.br/cidades/paisdeixam-crianca-de-4-anos-brincar-com-fosforo-e-casa-eincendiada-em-mg-1.2430627. Acesso em: 3 ago. 2021
(adaptado).
Na ponta do palito de fósforos existem várias substâncias, entre elas o trissulfeto de tetrafósforo (P4 S3 ). Essa substância inflama-se na presença de oxigênio, conforme descrito na equação química não balanceada a seguir:
P4 S3(s) + O2(g) → P4O10(s) + SO2(g)
Considerando que um palito de fósforo é constituído por 1.000 mg dessa substância, que por sua vez possui 40% em massa de trissulfeto de tetrafósforo, qual é a massa mais próxima do gás dióxido de enxofre (SO2 ), produzida quando um palito de fósforo se queima completamente?
Uma das ações do Corpo de Bombeiros Militar é orientar os banhistas de rios e lagoas quanto aos riscos de nadarem alcoolizados. Esses banhistas estão sujeitos ao afogamento, pois, ao consumirem álcool, ficam com a coordenação motora comprometida e perdem a percepção do perigo. Para ficar embriagada, uma pessoa que pesa 70 kg precisa ingerir 15 mL de etanol puro, que se acumula na corrente sanguínea, deixando-a sujeita ao afogamento.
Com base nas condições descritas e considerando que o teor alcoólico de uma cerveja seja de 5% V/V, qual quantidade mínima dessa bebida, em mililitros, ingerida por um indivíduo, poderia caracterizar sua embriaguez?
Sabendo-se que 1 mol de Ag contém 6,022 x 1023 átomos de Ag e pesa 107,9g, qual é a massa, em gramas, de um átomo de prata?
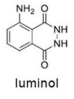
Tendo como referência a estrutura do luminol, apresentada anteriormente, e as informações do texto precedente, julgue o item a seguir, considerando que MH = 1 g/mol, MC = 12 g/mol, MN = 14 g/mol e MO = 16 g/mol.
Em 2 mols de moléculas de luminol, existem 14 × 1023
átomos de hidrogênio.
A partir das informações do texto apresentado, julgue o item a seguir, considerando que MH = 1,00 g/mol, MN = 14,00 g/mol, MO = 16,00 g/mol, MP = 31,00 g/mol e MS = 32,00 g/mol.
Considere que a obtenção do NH4H2PO4 se dê pela reação do
ácido fosfórico (H3PO4) com a amônia (NH3) em uma reação
com 100% de rendimento. Nesse caso, para a obtenção de
120 kg de NH4H2PO4, são necessários menos de 100 kg de
ácido fosfórico.
Uma mistura de carbonato de sódio decahidratado e bicarbonato de sódio foi colocada em um cadinho e levada a uma mufla a 350 °C por 3 h, tendo ocorrido as seguintes reações.
Na2CO3 · 10 H2O(s) → Na2CO3(s) + 10 H2O(v)
2 NaHCO3(s) → Na2CO3(s) + H2O(v) + CO2(g)
Finalizado o processo, restou unicamente carbonato de
sódio no cadinho, verificando-se uma perda total de massa de
6,70 g.
Sabendo que M(H) = 1 g/mol, M(C) = 12 g/mol,
M(O) = 16 g/mol e M(Na) = 23 g/mol, e supondo que a
quantidade de CO2 seco desprendido do cadinho seja igual a
2,20 g, assinale a opção que indica a quantidade, em gramas, de
Na2CO3 · 10 H2O existente na mistura inicial.
Uma reação que pode ocorrer com a pólvora é 2 KNO3 + S + 3 C → K2S + N2 + 3 CO2 Em uma reação completa, foram obtidos 135 kg de produtos, a partir da queima de 101 kg de nitrato de potássio e 16 kg de enxofre. A quantidade de carvão queimada, em quilogramas, foi de
Com os problemas de natureza sanitária causados pela pandemia gerada pela Covid-19, o Corpo de Bombeiros Militar de Minas Gerais tem realizado ações que visam orientar a população quanto ao uso do álcool em gel 70 ºINPM (grau INPM – Instituto Nacional de Pesos e Medidas) ou (70% p/p). O fato é que o álcool em gel se tornou um poderoso combatente no processo de higienização das mãos e proteção contra o novo coronavírus. Entretanto, não se deve nos esquecer de que, além de um eficiente desinfetante, o álcool é uma substância inflamável. Ele também tem sido a causa de muitos acidentes domésticos devido ao seu uso inadequado.
A equação a seguir representa a combustão de um mol de molécula do etanol:
CH3CH2OH + 3O2 → 2 CO2 + 3 H2O
ΔH° = - 1373kJ
O etanol é o tipo de álcool utilizado no álcool em gel.
Se considerar apenas o álcool 70 ºINPM como
constituinte do álcool em gel e que 460 g desse composto
foram completamente queimados, qual a energia, em kJ,
mais próxima liberada nesse processo?
CAMPOS, B. Instituto Geral de Perícias de Santa Catarina. Disponível em: <https://www.sc.gov.br/noticias/temas/defesa civil-e-bombeiros/perito-do-igp-explica-semelhancas-entreexplosao -em-beirute-e-incidente-em-sao-francisco-do-sul>. Acesso em: 20 ago. 2020 (Adaptação).
Considerando que 20 toneladas do fertilizante com 65%m/m em nitrato de amônio foram expostas ao acidente e todo o nitrato foi queimado, qual é a massa mais próxima, em toneladas, de nitrogênio, detonada na explosão?
O carbeto de cálcio, de fórmula CaC2 , é muito comum em equipamentos usados por exploradores de cavernas para fins de iluminação. Ele reage com água e gera como um dos produtos o gás acetileno (etino), de fórmula C2H2, conforme mostra a equação, não balanceada, a seguir
CaC2 (s) + H2O (l) → C2H2 (g) + Ca(OH)2 (s) (equação 1)
Sequencialmente, esse gás inflamável pode sofrer uma reação de combustão completa, liberando intensa energia, conforme a equação, não balanceada, a seguir
C2H2 (g) + O2 (g) → CO2 (g) + H2O (g) + calor (equação 2)
Uma massa de 512 g de carbeto de cálcio com pureza de 50% (e 50% de materiais inertes) é tratada com água, obtendo-se uma certa quantidade de gás acetileno. Esse gás produzido sofre uma reação de combustão completa.
Considerando a reação de combustão completa do acetileno nas condições ambientes (25ºC e 1 atm), o volume de gases obtidos e o valor da energia liberada como calor nessa reação, a partir da massa original de carbeto de cálcio, são, respectivamente,
Dados:
– volume molar na condição ambiente = 24,5 L · mol-1 (25ºC e 1 atm); calor de combustão do etino = -1298 kJ · mol-1 ; e
– constante universal dos gases R=0,082 L · atm · mol-1 · K-1 .
O fósforo branco, de fórmula P4, é uma substância bastante tóxica. É utilizado para fins bélicos como arma química de guerra em granadas fumígenas. Pode ser obtido a partir do aquecimento do fosfato de cálcio, areia e coque em um forno especial, conforme mostrado na equação balanceada da reação:
2 Ca3(PO4)2 (s) + 6 SiO2 (s) + 10 C (s) → 6 CaSiO3 (s) + 1 P4 (s) + 10 CO (g)
A respeito da reação de obtenção do fósforo branco, seus participantes e suas características são feitas as seguintes afirmativas.
I – O fósforo branco é classificado como uma substância iônica polar.
II – O fósforo branco (P4 ) é classificado como uma substância simples.
III – A geometria da molécula do gás monóxido de carbono é angular.
IV – A massa de fósforo branco obtida quando se aquece 1860 g de fosfato de cálcio com rendimento de 80% é de 297,6 g.
V – A distribuição eletrônica do átomo de cálcio no estado fundamental é: 1s2 2s2 2p6 3s2 3p5.
Das afirmativas feitas estão corretas apenas
O oxalato de cálcio é oxidado por permanganato de potássio em meio ácido. A equação não balanceada dessa reação é representada a seguir:
CaC2O4 + KMnO4 + H2SO4 → CaSO4 + K2SO4 + MnO2 + H2O + CO2
A soma dos coeficientes da equação da reação corretamente balanceada (menores números inteiros) e o volume de CO2 liberado quando se faz reagir 384 g de oxalato de cálcio por reação completa, na condição ambiente (25 ºC e 1 atm), são, respectivamente
Dados:
– volume molar nas condições ambiente de temperatura e pressão (25 ºC e 1 atm): 24,5 L · mol-1 ; e
– constante universal dos gases R=0,082 L · atm · mol-1 · K-1 .