Questões Militares
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 193 questões
Hidrogênio - 1 Carbono - 12 Nitrogênio - 14 Oxigênio - 16 Sódio - 23 Enxofre - 32 Cloro - 35,5 Cálcio - 40
CaCO3 → CaO + CO2
Quando a produção de CO2 é de 220g, a produção, em gramas, de CaO é
Hidrogênio - 1 Carbono - 12 Nitrogênio - 14 Oxigênio - 16 Sódio - 23 Enxofre - 32 Cloro - 35,5 Cálcio - 40
Hidrogênio - 1 Carbono - 12 Nitrogênio - 14 Oxigênio - 16 Sódio - 23 Enxofre - 32 Cloro - 35,5 Cálcio - 40
Em relação à composição química elementar da madeira, pode-se afirmar que não há diferenças consideráveis, levando-se em conta as madeiras de diversas espécies. Os principais elementos existentes são: Carbono (C)48%, Hidrogênio (H)6%, Oxigênio (O) 44% e Nitrogênio (N) 1%; além destes elementos encontram-se pequenas quantidades de cálcio (Ca), potássio (K), magnésio (Mg) e outros, constituindo as substâncias minerais existentes na madeira.
Em um churrasco realizado por um certo gaúcho, em sua residência, foi consumido 1,7 Kg de madeira para assar toda a carne. Supondo que a combustão do carbono seja completa, a quantidade em matéria (mol) formada de gás carbônico será:
Dados: C=12g/mol.
Com base nas informações acima e na tabela periódica, incluída no final deste caderno de provas, julgue os itens a seguir.
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
Considerando-se o valor aproximado de 6 × 1023 mol -1 para a constante de Avogadro, infere-se que, quando são colocados 1,8 × 1024 átomos de bário e 2 mols de gás oxigênio em reação, formam-se mais de 400 g de BaO.
A quantidade de matéria de H2SO4 derramada é superior a 190.000 mol.

Com base nessas informações e considerando
 a variação de
a variação deentalpia padrão das reações a 25 ºC, julgue os itens a seguir.
Em uma eletrólise ígnea do cloreto de sódio, uma corrente elétrica, de intensidade igual a 5 ampères, atravessa uma cuba eletrolítica, com o auxilio de dois eletrodos inertes, durante 1930 segundos.
O volume do gás cloro, em litros, medido nas CNTP, e a massa de sódio, em gramas, obtidos nessa eletrólise, são, respectivamente:
A composição química do cimento Portland, utilizado na construção civil, varia ligeiramente conforme o que está indicado na tabela abaixo:
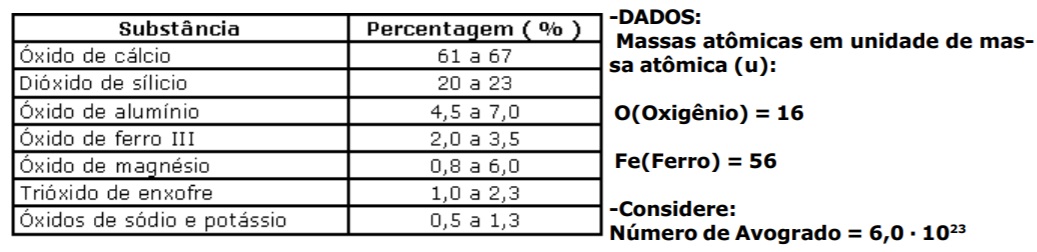
Assinale a alternativa correta:
Um laboratorista pesou separadamente uma amostra I, de hidróxido de sódio (NaOH), e uma amostra II, de óxido de cálcio (CaO), e, como não dispunha de etiquetas, anotou somente a soma das massas das amostras (I + II) igual a 11,2 g.
Cada uma das amostras I e II foi tratada separadamente com ácido sulfúrico (H 2SO4) produzindo, respectivamente, sulfato de sódio (Na2SO4) mais água (H2O) e sulfato de cálcio (CaSO4) mais água (H2O). Considere o rendimento das reações em questão igual a 100%.
Sendo a soma das massas dos sais produzidos (Na 2SO4 + CaSO4) igual a 25,37 g, então a massa da amostra I de hidróxido de sódio (NaOH) e a massa de amostra II de óxido de cálcio (CaO) são, respectivamente:
Dados:

A concentração em mol · L-1 dos íons sulfato ( SO
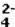 ) presentes na solução final é :
) presentes na solução final é :
4 C3H5(NO3)3(l) → 6 N2(g) + 12 CO(g) + 10 H2O(g) + 7 O2(g)
Considerando os gases acima como ideais, a temperatura de 300 Kelvin (K) e a pressão de 1 atm, o volume gasoso total que será produzido na detonação completa de 454 g de C3H5(NO3)3(l) é:
Dados:
Elemento H(hidrogênio) C( carbono) O ( Oxigênio) N( nitrogênio)
Massa 1 12 16 14
atômica(u)
Constante universal dos gases: R=8,2 · 10-2 atm · L · K-1 · mol-1

