Questões Militares
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 191 questões
Adaptado de g1.globo.com, 07/01/2024.
Com base no estabelecido pela OMS, a concentração máxima permitida de CO, em mol/L, é aproximadamente igual a:
O gráfico a seguir apresenta os resultados obtidos para a relação entre massa e volume de cada uma dessas amostras, medidos a 25ºC.
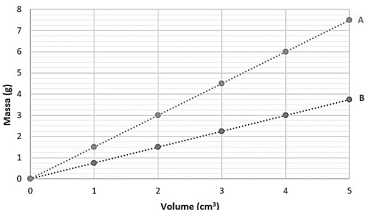
A partir dos dados apresentados é possível afirmar que, nessa temperatura, a razão entre as densidades das amostras A e B é igual a
II. Em uma mistura de octano e oxigênio, o combustível representa aproximadamente 78% da massa total.
III. A variação de temperatura da reação de combustível e oxigênio (por mol de combustível) é igual à variação de temperatura da reação de combustível e ar atmosférico (por mol de combustível).
IV. A entalpia molar de combustão de uma mistura de combustível e oxigênio é igual à entalpia molar de combustão de uma mistura de combustível e ar atmosférico. Assinale a opção que contém as afirmações CORRETAS.
Na + CH3 CH2 OH → CH3 CH2 ONa + H2
Considerando que nas CATP (Condições Ambientais de Temperatura e Pressão) 1 mol de qualquer gás ocupa 25 L, o volume de H2 produzido, quando reagem 1 g de sódio e 1 g etanol, e a massa do excesso de reagente são, respectivamente,
Pb(NO3)2 + 2KI → PbI2 + 2KNO3 CH3NH2 + HI → CH3NH3I PbI2 + CH3NH3I → CH3NH3PbI3
Os seguintes reagentes foram empregados na síntese: 0,6 mol de Pb(NO3)2; 0,8 mol de KI; 0,7 mol de CH3NH2; e 0,8 mol de HI. Nessas condições, qual será a quantidade máxima da perovskita CH3NH3PbI3 produzida?
Considerando o nível de glicose citado de 50mg/dL (considere 1dL = 0,1L), é CORRETO afirmar que a conversão desta unidade de concentração em mmol/L de glicose chegará ao valor aproximado de:
H2(g) + O2(g) → H2O(l)
É CORRETO afirmar que, para 342g de gás oxigênio, a massa de gás hidrogênio necessária para a reação completa será aproximadamente de:
2. HCOONa + H2SO4 → 2HCOOH + Na2SO4
Uma solução aquosa foi preparada a partir da dissolução de 6,8 g de metanoato de sódio em 100 ml de água. Essa solução preparada reagiu com uma solução de ácido sulfúrico com centração de 0,2 mol/L para formação do ácido fórmico. Sabendo que a quantidade de solução de ácido sulfúrico foi a quantidade estequiométrica para completar a reação de síntese, a concentração da solução de metanoato de sódio preparada e a quantidade de solução de ácido sulfúrico adicionada, respectivamente, foram:
Massa molar: Na=23 g/mol; C=12 g/mol; O=12 g/mol; O=16 g/mol; H=1 g/mol
Sobre esse assunto, é correto afirmar que: