Questões Militares
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 195 questões
Massa molar: O=16 g/mol; H=1 g/mol; C=12 g/mol.
2. HCOONa + H2SO4 → 2HCOOH + Na2SO4
Uma solução aquosa foi preparada a partir da dissolução de 6,8 g de metanoato de sódio em 100 ml de água. Essa solução preparada reagiu com uma solução de ácido sulfúrico com centração de 0,2 mol/L para formação do ácido fórmico. Sabendo que a quantidade de solução de ácido sulfúrico foi a quantidade estequiométrica para completar a reação de síntese, a concentração da solução de metanoato de sódio preparada e a quantidade de solução de ácido sulfúrico adicionada, respectivamente, foram:
Massa molar: Na=23 g/mol; C=12 g/mol; O=12 g/mol; O=16 g/mol; H=1 g/mol
O sulfeto de alumínio é um sólido que pode ser obtido, em condições adequadas, entre a reação do alumínio e do gás sulfeto de hidrogênio de alta pureza. Nessa reação, forma-se gás hidrogênio como subproduto.
Ao serem misturados 3,0 mol de alumínio e 6,0 mol de sulfeto de hidrogênio nas condições adequadas para reação, a quantidade máxima, em mol, de sulfeto de alumínio que poderá ser formada e a massa do reagente em excesso são:
A fosfina, PH3 , é uma substância gasosa em temperatura ambiente que pode ser obtida a partir da reação do fosfeto de cálcio sólido com água. Nessa reação, forma-se também o hidróxido de cálcio.
Uma certa massa de fosfeto de cálcio foi adicionada em água em um béquer aberto totalizando uma mistura reacional com massa igual a 1.000 g. Ao término da reação com consumo total do fosfeto de cálcio, a massa da mistura no interior do béquer era igual a 796 g.
A massa de água da mistura reacional no béquer era igual a
2 H2(g) + O2(g) → 2 H2O(g)
Nessa reação, o hidrogênio reage com o oxigênio em proporção 1:8 (em massa).
A esse respeito, analise as afirmativas a seguir.
I. A combustão completa de 5g de hidrogênio requer 40g de oxigênio.
II. A mistura de 4g de hidrogênio com 16g de oxigênio deverá gerar 20g de água.
III. A combustão de 2g de hidrogênio gera 2g de água.
Está correto o que se afirma em


Considere as massas atômicas C: 12g mol–1, H: 1g mol–1 e O: 16gmol–1.
A massa molecular do ácido oxálico, em g mol–1, é
O RDX, explosivo de grande aplicação militar, tem a seguinte fórmula molecular:
C3H6N6O6
Assim, qual a massa de Nitrogênio em uma embalagem de 11,1 kg de RDX?
Dados: Massas atômicas: C=12,H=1,N=14 e O=16.
PO43− + 12MoO42− + 27H+ → H3PMo12O40 + 12H2O
Nesse teste, a quantidade de matéria de MoO42− necessária para uma amostra de 10 mL contendo 2 mg L−1 de H3PO4 (98 g mol−1 ) é mais próxima de:
Dados: 1 mg = 10−3 g; 1 mL = 10−3 L
O número de mols presente em uma amostra de 262g de bicarbonato de sódio (NaHCO3) é aproximadamente
Dado: Massa Molar NaHCO3 = 84g/mol
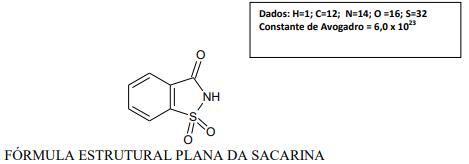
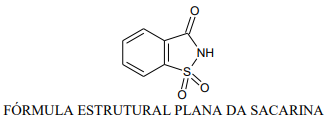
Dados: H=1; C=12; N=14; O =16; S=32 Constante de Avogadro = 6,0 x 1023
Disponível em: <http://g1.globo.com/sp/campinas-regiao/noticia/2012/05/carreta- com-produto-quimico-tomba-em-curva-de-rodovia-em-paulinia-sp.html>. Acesso em: 9 de ago. 2021 (adaptado).
O cumeno, cuja nomenclatura é isopropilbenzeno, pode ser explorado industrialmente para a produção de fenol e propanona pelo processo de oxidação descrito na equação química a seguir:
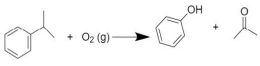
Considerando que todo o produto na carreta seja 100% puro, o qual seria completamente consumido na produção de 7,5 toneladas de fenol, qual é o valor aproximado previsto do rendimento dessa reação?
Sabe-se que a soda cáustica é o nome usual do hidróxido de sódio (NaOH), que é comercializada no estado sólido no qual, em alguns produtos disponíveis, o grau de pureza é cerca de 90% em massa. No laboratório, quando se deseja neutralizar 10 g de soda cáustica, são necessários 100 mililitros de solução de ácido clorídrico (HCl).
Com base nessas informações, qual é a concentração, em mol/L, do ácido clorídrico necessária para neutralizar completamente a soda cáustica?
Conforme descrito pelo Corpo de Bombeiros Militar de Minas Gerais, um incêndio destruiu parte de uma casa no norte do estado de Minas Gerais. O acidente ocorreu quando uma criança de 4 anos brincava com uma caixinha de fósforos.
Disponível em: https://www.otempo.com.br/cidades/paisdeixam-crianca-de-4-anos-brincar-com-fosforo-e-casa-eincendiada-em-mg-1.2430627. Acesso em: 3 ago. 2021
(adaptado).
Na ponta do palito de fósforos existem várias substâncias, entre elas o trissulfeto de tetrafósforo (P4 S3 ). Essa substância inflama-se na presença de oxigênio, conforme descrito na equação química não balanceada a seguir:
P4 S3(s) + O2(g) → P4O10(s) + SO2(g)
Considerando que um palito de fósforo é constituído por 1.000 mg dessa substância, que por sua vez possui 40% em massa de trissulfeto de tetrafósforo, qual é a massa mais próxima do gás dióxido de enxofre (SO2 ), produzida quando um palito de fósforo se queima completamente?
Uma das ações do Corpo de Bombeiros Militar é orientar os banhistas de rios e lagoas quanto aos riscos de nadarem alcoolizados. Esses banhistas estão sujeitos ao afogamento, pois, ao consumirem álcool, ficam com a coordenação motora comprometida e perdem a percepção do perigo. Para ficar embriagada, uma pessoa que pesa 70 kg precisa ingerir 15 mL de etanol puro, que se acumula na corrente sanguínea, deixando-a sujeita ao afogamento.
Com base nas condições descritas e considerando que o teor alcoólico de uma cerveja seja de 5% V/V, qual quantidade mínima dessa bebida, em mililitros, ingerida por um indivíduo, poderia caracterizar sua embriaguez?
Sabendo-se que 1 mol de Ag contém 6,022 x 1023 átomos de Ag e pesa 107,9g, qual é a massa, em gramas, de um átomo de prata?
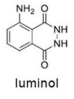
Tendo como referência a estrutura do luminol, apresentada anteriormente, e as informações do texto precedente, julgue o item a seguir, considerando que MH = 1 g/mol, MC = 12 g/mol, MN = 14 g/mol e MO = 16 g/mol.
Em 2 mols de moléculas de luminol, existem 14 × 1023
átomos de hidrogênio.
A partir das informações do texto apresentado, julgue o item a seguir, considerando que MH = 1,00 g/mol, MN = 14,00 g/mol, MO = 16,00 g/mol, MP = 31,00 g/mol e MS = 32,00 g/mol.
Considere que a obtenção do NH4H2PO4 se dê pela reação do
ácido fosfórico (H3PO4) com a amônia (NH3) em uma reação
com 100% de rendimento. Nesse caso, para a obtenção de
120 kg de NH4H2PO4, são necessários menos de 100 kg de
ácido fosfórico.
Uma mistura de carbonato de sódio decahidratado e bicarbonato de sódio foi colocada em um cadinho e levada a uma mufla a 350 °C por 3 h, tendo ocorrido as seguintes reações.
Na2CO3 · 10 H2O(s) → Na2CO3(s) + 10 H2O(v)
2 NaHCO3(s) → Na2CO3(s) + H2O(v) + CO2(g)
Finalizado o processo, restou unicamente carbonato de
sódio no cadinho, verificando-se uma perda total de massa de
6,70 g.
Sabendo que M(H) = 1 g/mol, M(C) = 12 g/mol,
M(O) = 16 g/mol e M(Na) = 23 g/mol, e supondo que a
quantidade de CO2 seco desprendido do cadinho seja igual a
2,20 g, assinale a opção que indica a quantidade, em gramas, de
Na2CO3 · 10 H2O existente na mistura inicial.