Questões Militares
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 195 questões
A nitroglicerina é um líquido oleoso de coloração amarela, levemente esverdeada, da classe dos explosivos, substâncias que se decompõem rapidamente, com expansão súbita de gases e grande liberação de energia. Possui massa molecular de 227g.mol-1 e sua temperatura não deve ultrapassar 30°C, nem ser exposta a choques mecânicos. A nitroglicerina é obtida através da nitração da glicerina, utilizando ácido sulfúrico como catalisador. A reação da decomposição da nitroglicerina pode ser escrita como:
4C3 H5 N3 O9(l) → 10H2O(g) + 6N2(g) + O2(g) + 12CO2(g)
Sabendo que a constante dos gases é igual a 8,314J.mol-1.K-1, a decomposição de 227g de nitroglicerina a
27°C e 1,01kPa, vai liberar cerca de quantos litros de gases?
Marque a proporção correta abaixo que obedece à lei de Gay-Lussac para os seguintes volumes que participam de uma reação química e que foram medidos em condições idênticas de pressão e temperatura:
1,36LN2 + 4.08L H2 → 2,72L NH3
A respeito da matéria e de sua constituição química, julgue o item a seguir.
A massa molecular das substâncias é dada pela soma das
massas de todos os átomos que constituem suas moléculas
ou fórmulas mínimas.
A respeito da matéria e de sua constituição química, julgue o item a seguir.
O mol é a unidade de medida da grandeza quantidade
de matéria.
A emissão de gases derivados do enxofre, como o dióxido de enxofre (SO2), pode ocasionar uma série de problemas ambientais e a destruição de materiais como rochas e monumentos à base de calcita (carbonato de cálcio). Essa destruição ocasiona reações com a emissão de outros gases, como o gás carbônico (CO2), potencializando o efeito poluente. Considerando as equações das reações sucessivas a 27 °C e 1 atm, admitindo-se os gases como ideais e as reações completas, o volume de CO2 produzido a partir da utilização de 2 toneladas de SO2 como reagente é, aproximadamente,
Dados
Massas Atômicas: S = 32 u ; O = 16 u ; H = 1 u ; C = 12 u ; Ca = 40 u
Constante dos gases ideais: R = 0,082 atm L
L mol-1
mol-1 K-1
K-1
Volume molar nas condições em que ocorreu a reação (27° e 1 atm) = 24,6 L/mol
SO2 (g) + 1/2 O2 (g) → SO3 (g) (equação I)
SO3 (g) + H2O (ℓ) → H2SO4 (ℓ) (equação II)
H2SO4 (ℓ) + CaCO3 (s) → CaSO4 (s) + H2O (ℓ) + CO2 (g) (equação III)
“Certo gás em temperatura de 27°C e 1 atm, dentro de um recipiente isotérmico, sofreu uma variação em sua pressão, passando a ser 1,5 atm.”
Assinale a alternativa que corresponde à quantidade de mols existente dentro do recipiente.
(Dados: V = 22,4L; R = 0,082 atm. L / mol . K.)
A nitroglicerina é um líquido oleoso de cor amarelo-pálida. É altamente sensível ao choque. O simples ato de balançar o líquido pode causar a explosiva decomposição em gases de nitrogênio, dióxido de carbono, água e oxigênio. A equação química abaixo representa essa reação.
4C3H5N3O9 (l ) → 6N2 (g ) + 12CO2 (g ) + 10H2O (g ) + O2 (g )
Calcule o volume de gases CO2 produzido quando uma amostra de 200 gramas de nitroglicerina é detonada. Considere os seguintes dados: Massa g/mol: H = 1; C = 12; N = 14; O = 16; Constante universal dos gases: R = 8,2 · 10−2 atm · L · K−1 · mol−1; Pressão: 1 atm; Temperatura: 27°C e Volume Molar: 22,4 L . mol-1.
Mediante análise, marque a alternativa que apresenta corretamente o volume aproximado.
A soda cáustica é o nome comercial dado ao composto hidróxido de sódio (NaOH). Este composto é largamente aplicado na indústria para a purificação de derivados de petróleo e de óleos vegetais. É também utilizado na fabricação de produtos de uso doméstico, como o sabão.
Dado: MM (NaOH) = 40,00g/mol, qual a concentração em quantidade de matéria de uma solução que foi
preparada dissolvendo-se 200,00g de hidróxido de sódio em água e completando-se para 2,00L de solução?
CrCl3 + NaOH + H2O2 → Na2CrO4 + NaCl + H2O
Dados – M (g mol-1 ): H = 1; C = 12; N = 14; O = 16.
Qual é o valor da massa molar (em g mol-1 ) desse composto?
CONSTANTES

DEFINIÇÕES


CONSTANTES

DEFINIÇÕES


A explosão de 8,8 L de trinitroglicerina (TNG, d = 1,59 g/m L) que ocorreu com 100% de rendimento, pode ser expressa pela equação química a seguir:
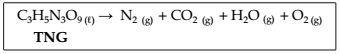
Supondo que todo o gás carbônico produzido possa
ser captado, quantos extintores de incêndio com
capacidade para 2 kg desse gás, poderiam ser
envasados aproximadamente?
A equação a seguir apresenta uma importante reação para a produção do ferro metálico a partir do minério de ferro.
Fe30 4 + 4 H 2 —► 3 Fe + 4 H20
Com base nessa equação, se colocarmos para reagir
entre si 348g de Fe3O4 e 16g de H2, considerando que o
rendimento da reação seja de 100%, é correto afirmar que: