Questões Militares
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
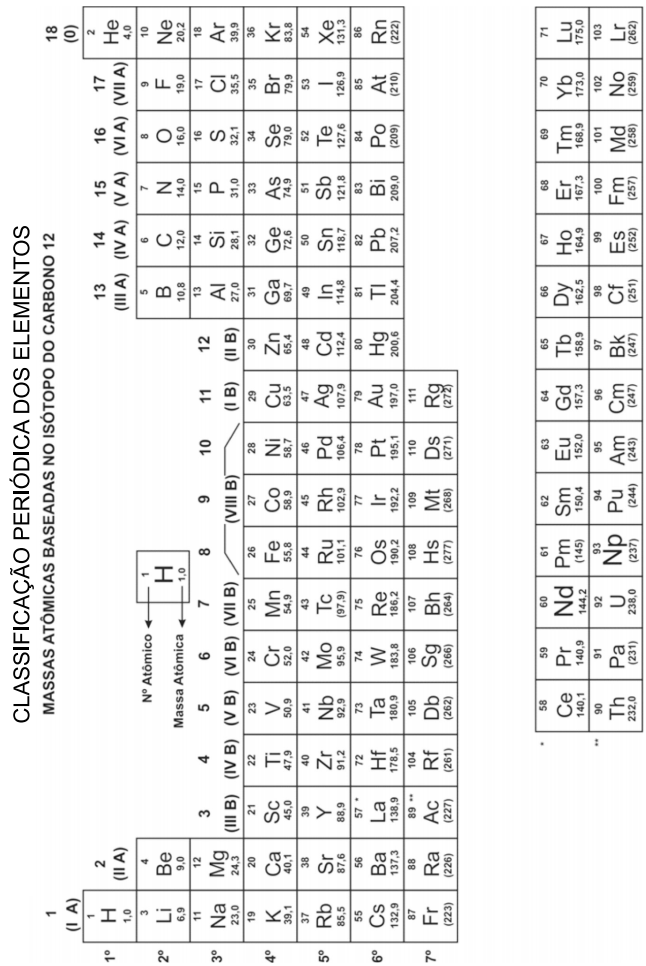
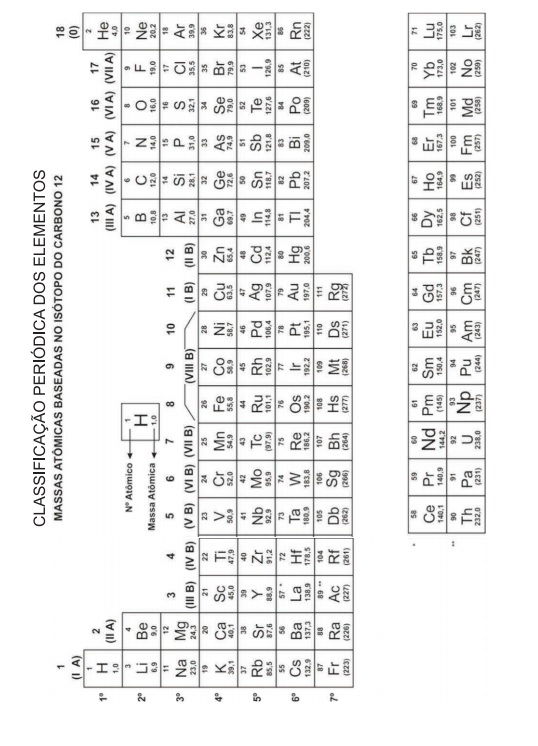
Foram encontradas 191 questões
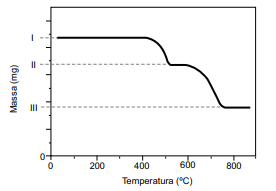
A decomposição térmica do oxalato de cálcio anidro inicia em cerca de 400 ºC e ocorre em duas etapas representadas pelas equações. O composto sólido formado na primeira reação se decompõe em cerca de 600 o C.
CaC2O4 (s) → CaCO3 (s) + CO (g) CaCO3 (s) → CaO (s) + CO2 (g)
O resultado da análise é apresentado na forma de uma curva da variação de massa em função da temperatura ao longo do processo de aquecimento.
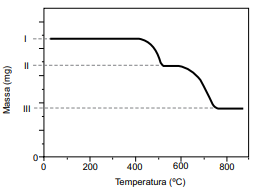
(Cavalheir, E. T. G.; et al. Química Nova. Adaptado)
I. 51,2 mg da amostra da mistura de CaC2O4 e SiO2. II. 42,8 mg. III. 29,6 mg.
O teor de oxalato de cálcio nessa amostra é de
Uma reação que pode ocorrer com a pólvora é 2 KNO3 + S + 3 C → K2S + N2 + 3 CO2 Em uma reação completa, foram obtidos 135 kg de produtos, a partir da queima de 101 kg de nitrato de potássio e 16 kg de enxofre. A quantidade de carvão queimada, em quilogramas, foi de
Com os problemas de natureza sanitária causados pela pandemia gerada pela Covid-19, o Corpo de Bombeiros Militar de Minas Gerais tem realizado ações que visam orientar a população quanto ao uso do álcool em gel 70 ºINPM (grau INPM – Instituto Nacional de Pesos e Medidas) ou (70% p/p). O fato é que o álcool em gel se tornou um poderoso combatente no processo de higienização das mãos e proteção contra o novo coronavírus. Entretanto, não se deve nos esquecer de que, além de um eficiente desinfetante, o álcool é uma substância inflamável. Ele também tem sido a causa de muitos acidentes domésticos devido ao seu uso inadequado.
A equação a seguir representa a combustão de um mol de molécula do etanol:
CH3CH2OH + 3O2 → 2 CO2 + 3 H2O
ΔH° = - 1373kJ
O etanol é o tipo de álcool utilizado no álcool em gel.
Se considerar apenas o álcool 70 ºINPM como
constituinte do álcool em gel e que 460 g desse composto
foram completamente queimados, qual a energia, em kJ,
mais próxima liberada nesse processo?
CAMPOS, B. Instituto Geral de Perícias de Santa Catarina. Disponível em: <https://www.sc.gov.br/noticias/temas/defesa civil-e-bombeiros/perito-do-igp-explica-semelhancas-entreexplosao -em-beirute-e-incidente-em-sao-francisco-do-sul>. Acesso em: 20 ago. 2020 (Adaptação).
Considerando que 20 toneladas do fertilizante com 65%m/m em nitrato de amônio foram expostas ao acidente e todo o nitrato foi queimado, qual é a massa mais próxima, em toneladas, de nitrogênio, detonada na explosão?
O carbeto de cálcio, de fórmula CaC2 , é muito comum em equipamentos usados por exploradores de cavernas para fins de iluminação. Ele reage com água e gera como um dos produtos o gás acetileno (etino), de fórmula C2H2, conforme mostra a equação, não balanceada, a seguir
CaC2 (s) + H2O (l) → C2H2 (g) + Ca(OH)2 (s) (equação 1)
Sequencialmente, esse gás inflamável pode sofrer uma reação de combustão completa, liberando intensa energia, conforme a equação, não balanceada, a seguir
C2H2 (g) + O2 (g) → CO2 (g) + H2O (g) + calor (equação 2)
Uma massa de 512 g de carbeto de cálcio com pureza de 50% (e 50% de materiais inertes) é tratada com água, obtendo-se uma certa quantidade de gás acetileno. Esse gás produzido sofre uma reação de combustão completa.
Considerando a reação de combustão completa do acetileno nas condições ambientes (25ºC e 1 atm), o volume de gases obtidos e o valor da energia liberada como calor nessa reação, a partir da massa original de carbeto de cálcio, são, respectivamente,
Dados:
– volume molar na condição ambiente = 24,5 L · mol-1 (25ºC e 1 atm); calor de combustão do etino = -1298 kJ · mol-1 ; e
– constante universal dos gases R=0,082 L · atm · mol-1 · K-1 .
O fósforo branco, de fórmula P4, é uma substância bastante tóxica. É utilizado para fins bélicos como arma química de guerra em granadas fumígenas. Pode ser obtido a partir do aquecimento do fosfato de cálcio, areia e coque em um forno especial, conforme mostrado na equação balanceada da reação:
2 Ca3(PO4)2 (s) + 6 SiO2 (s) + 10 C (s) → 6 CaSiO3 (s) + 1 P4 (s) + 10 CO (g)
A respeito da reação de obtenção do fósforo branco, seus participantes e suas características são feitas as seguintes afirmativas.
I – O fósforo branco é classificado como uma substância iônica polar.
II – O fósforo branco (P4 ) é classificado como uma substância simples.
III – A geometria da molécula do gás monóxido de carbono é angular.
IV – A massa de fósforo branco obtida quando se aquece 1860 g de fosfato de cálcio com rendimento de 80% é de 297,6 g.
V – A distribuição eletrônica do átomo de cálcio no estado fundamental é: 1s2 2s2 2p6 3s2 3p5.
Das afirmativas feitas estão corretas apenas
O oxalato de cálcio é oxidado por permanganato de potássio em meio ácido. A equação não balanceada dessa reação é representada a seguir:
CaC2O4 + KMnO4 + H2SO4 → CaSO4 + K2SO4 + MnO2 + H2O + CO2
A soma dos coeficientes da equação da reação corretamente balanceada (menores números inteiros) e o volume de CO2 liberado quando se faz reagir 384 g de oxalato de cálcio por reação completa, na condição ambiente (25 ºC e 1 atm), são, respectivamente
Dados:
– volume molar nas condições ambiente de temperatura e pressão (25 ºC e 1 atm): 24,5 L · mol-1 ; e
– constante universal dos gases R=0,082 L · atm · mol-1 · K-1 .
CaC2O4 (s) ➝ CaCO3 (s) + CO (g) CaCO3 (s) ➝ CaO (s) + CO2 (g)
O resultado da análise é apresentado na forma de uma curva da variação de massa em função da temperatura ao longo do processo de aquecimento.
(Cavalheir, E. T. G.; et al. Química Nova. Adaptado)
I. 51,2 mg da amostra da mistura de CaC2 O4 e SiO2 . II. 42,8 mg. III. 29,6 mg.
O teor de oxalato de cálcio nessa amostra é de
Considerando que a reação cessa após o consumo total do reagente limitante, ao serem misturados 12 mol de cada um dos reagentes, a quantidade máxima de fosfeto de boro que pode ser formada e a quantidade total de reagentes que permanecem sem reagir são, respectivamente,
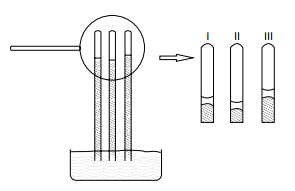
Nesse experimento, a água, a solução de cloreto de sódio e a solução de glicose estão contidas, respectivamente, nos tubos
O ânion perxenato (XeO6 4- ) é um oxidante muito forte, capaz de oxidar Mn(II) a Mn(VII), conforme a equação química abaixo:
5 Na4XeO6(aq) + 8 MnSO4(aq) + 2 H2O(l) → 5 Xe(g) + 8 NaMnO4(aq) + 6 Na2SO4(aq) + 2 H2SO4(aq)
Além disso, o XeO6 4- é um oxidante limpo, pois não introduz produtos de redução no meio da reação, uma vez que o xenônio formado está na forma de gás.
Um experimento foi realizado na temperatura de 300 K e 100 kPa, em que 16 mol de MnSO4 foram totalmente oxidados por Na4XeO6 e todo o gás produzido foi coletado. Nessas condições, o volume de um mol de um gás ideal é igual a 24,9 L.
O volume (em L) de gás coletado nesse experimento foi igual a:
A combustão completa do eicosano, um dos componentes da parafina utilizada para formar velas, é representada pela seguinte equação, não balanceada:
___ C20H42 + ___ O2 → ___ CO2 + ___H2O
Nessa equação, quando o coeficiente estequiométrico do
eicosano for 2, o do oxigênio será
Com o avanço crescente da violência nas grandes cidades, o uso de armas não letais pelas polícias e forças armadas, no intuito de dispersar ou controlar multidões em protestos ou manifestações violentas, vem crescendo cada vez mais no Brasil. Entre essas armas, os compostos lacrimogêneos destacam-se como um poderoso agente, provocando irritação nos olhos, acompanhada por lacrimação, assim como irritações na pele e nas vias respiratórias. Os lacrimogêneos são constituídos de três compostos que são utilizados separadamente: o cloroacetofenona (CN), o 2-clorobenilideno malononitrila (CS) e dibenz-1:4-oxazepina (CR).
A seguir estão representadas as estruturas desses três compostos:
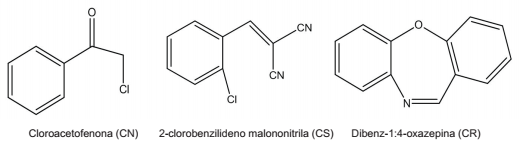
Sobre esses compostos, foram feitas as seguintes afirmativas:
I. Um mol de molécula do composto CN tem 5 pares de elétrons não ligantes.
II. Um mol de molécula do composto CS tem 4 ligações pi.
III. Um mol de molécula do composto CR tem 9 mols de átomos de hidrogênio.
IV. Somente o composto CS tem mais de um carbono primário.
Estão corretas as afirmativas
O módulo de descida lunar da Apoio utilizou a dimetil-hidrazina (CH3)2NNH2 como combustível juntamente com o N2O4 líquido como oxidante. A reação química entre os dois reagentes no motor do foguete ocorre conforme descrito na equação química balanceada a seguir:
(CH3)2NNH2 + 2N2O4 → 4H2O + 2CO2 + 3N2

I – O agente oxidante dessa reação é o O2.
II – O coeficiente estequiométrico da água, após o balanceamento da equação, é 2.
III – Considerando a densidade do etanol 0,8 g/mL (25 ºC; 1 atm), a combustão completa de 1150 mL desse composto libera aproximadamente 27360 kJ.
IV – A quantidade de calor liberada na combustão de 1 mol de etanol é de 278 kJ·mol-1.
Das afirmativas feitas estão corretas apenas
Em condições ideais, pequenas quantidades de gás cloro podem ser geradas em laboratório pela reação do óxido de manganês (MnO2 ) com ácido clorídrico (HCl), conforme a equação química a seguir não balanceada.
HCl(aq) + MnO2 (s) → H2O(L) + MnCl2(s) + Cl2(g)
A partir dessas informações, quantas moléculas de gás cloro, aproximadamente, podem ser produzidas quando 10 g de óxido de manganês com grau de pureza de 87% são colocados para reagir completamente com excesso de ácido clorídrico?
Dado: Número de Avogadro (N) = 6 x 1023
A nitroglicerina é um líquido oleoso de coloração amarela, levemente esverdeada, da classe dos explosivos, substâncias que se decompõem rapidamente, com expansão súbita de gases e grande liberação de energia. Possui massa molecular de 227g.mol-1 e sua temperatura não deve ultrapassar 30°C, nem ser exposta a choques mecânicos. A nitroglicerina é obtida através da nitração da glicerina, utilizando ácido sulfúrico como catalisador. A reação da decomposição da nitroglicerina pode ser escrita como:
4C3 H5 N3 O9(l) → 10H2O(g) + 6N2(g) + O2(g) + 12CO2(g)
Sabendo que a constante dos gases é igual a 8,314J.mol-1.K-1, a decomposição de 227g de nitroglicerina a
27°C e 1,01kPa, vai liberar cerca de quantos litros de gases?
Marque a proporção correta abaixo que obedece à lei de Gay-Lussac para os seguintes volumes que participam de uma reação química e que foram medidos em condições idênticas de pressão e temperatura:
1,36LN2 + 4.08L H2 → 2,72L NH3