Questões Militares
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 191 questões
A fermentação da glicose (C6H12O6) produz álcool etílico (C2H5OH) , que no Brasil é utilizado como combustível. A equação abaixo representa esse processo.
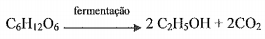
Assinale a opção que apresenta a quantidade de gramas de álcool etílico que é produzida a partir da fermentação de 18 Kg de glicose.
Dados : H= 1 g/mol
C= 12 g/mol
O= 16 g/mol
0 tricloreto de fósforo (PCI3) pode ser preparado a partir da reação do fósforo branco (P4) com o cloro gasoso (CI2), de acordo com a equação a seguir

Assinale a opção que apresenta a quantidade de gramas de cloro gasoso que é necessária para reagir com 310 gramas de fósforo branco.
Dados : P = 31 g/mol
Cl = 35,5 g / mol .
O aspartame é um aditivo alimentar utilizado para substituir o açúcar comum em vários alimentos e bebidas.
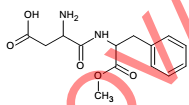
Fórmula estrutural do aspartame
Com base nessas informações, assinale a alternativa correta.
No esboço da Tabela Periódica abaixo estão discriminados os números de nêutrons dos isótopos mais estáveis de alguns elementos.
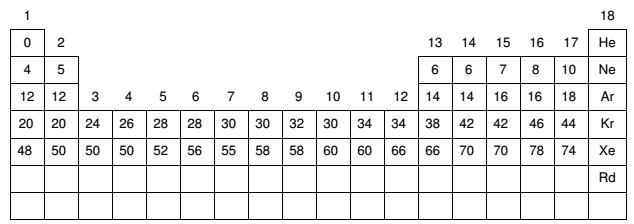
Considere agora um composto iônico binário, em que:
(i) o cátion, de carga +2, possui 12 prótons;
(ii) o ânion, de carga –3, possui 10 elétrons.
A massa de 1 mol deste composto é aproximadamente igual a:
Uma solução aquosa saturada de gás sulfídrico possui concentração igual a 0,1M e constante de ionização igual a 10-22 Calcule a concentração de sulfeto necessária para precipitação dos cátions do segundo Grupo, sabendo-se que o pH deve ser regulado para se obter uma solução 0,25M em ácido clorídrico, e assinale a opção correta.
Dados: H2S → 2 H+ + S-2
O fósforo elementar é, industrialmente, obtido pelo aquecimento do fosfato de cálcio com coque na presença de sílica de acordo com as seguintes reações:
2 Ca3 (PO4) 2 + 6 SiO2 → 6 CaSiO3 + P4O10
P4O10 + 10 C → P4 + 10 CO
Calcule quantos gramas de fosfato de cálcio são necessários
para produzir 46,5 g de fósforo elementar, e assinale a
opção correta.
O perclorato de potássio (KClO4) é usado como oxidante em propelentes e pirotécnicos. Calcule o calor necessário para aumentar a temperatura de 5,0 g de KClO4, de 25°C até 90° C, e assinale a opção correta.
Dado: Capacidade calorífica específica do KClO4 = 0,8111 J.K-1 . g-1
Uma amostra de gás metano (CH4) foi aquecida, lentamente, na pressão constante de 0,90 bar. O volume de gás foi medido em diversas temperaturas e um gráfico de volume versus temperatura foi construído. Sabendo que o valor da inclinação da reta encontrado para o citado gráfico foi de 2,88 x 10-4 L.K-1 , qual é o valor correspondente à massa do gás metano?
Dados:
1) Considerar o gás metano como ideal; e
2) R = 8,314 x 10-2 L.bar.K-1 . mol-1
Uma das aplicações da trinitroglicerina, cuja fórmula é C3H3N3O9, é a confecção de explosivos. Sua decomposição enérgica gera como produtos os gases nitrogênio, dióxido de carbono e oxigênio, além de água, conforme mostra a equação da reação a seguir:
4 C3H3N3O9 (l) → 6 N2 (g) + 12 CO2 (g) + 1 O2 (g) + 10 H2O (l).
Além de explosivo, a trinitroglicerina também é utilizada como princípio ativo de medicamentos no tratamento de angina, uma doença que acomete o coração. Medicamentos usados no tratamento da angina usam uma dose padrão de 0,6 mg de trinitroglicerina na formulação. Considerando os dados termoquímicos da reação a 25 ºC e 1 atm e supondo que essa massa de trinitroglicerina sofra uma reação de decomposição completa, a energia liberada seria aproximadamente de
Dados: massas atômicas: C = 12 u; H = 1 u; N = 14 u; O = 16 u.
∆Hof (H2O) = - 286 kJ/mol; ∆Hof
(CO2) = - 394 kJ/mol; ∆Hof
(C3H5N3O9) = - 353,6 kJ/mol
Um mineral muito famoso, pertencente ao grupo dos carbonatos, e que dá origem a uma pedra semipreciosa é a malaquita, cuja a fórmula é: Cu2(OH)2CO3 (ou CuCO3.Cu(OH)2).
Experimentalmente pode-se obter malaquita pela reação de precipitação que ocorre entre soluções aquosas de sulfato de cobre II e carbonato de sódio, formando um carbonato básico de cobre II hidratado, conforme a equação da reação:
2 CuSO4 (aq) + 2 Na2CO3 (aq) + H2O (l) → CuCO3.Cu(OH)2 (s) + 2 Na2SO4 (aq) + CO2 (g)
Na reação de síntese da malaquita, partindo-se de 1060 g de carbonato de sódio e considerando-se um rendimento de reação de 90%, o volume de CO2 (a 25 ºC e 1 atm) e a massa de malaquita obtida serão, respectivamente, de:
Dados: – massas atômicas Cu = 64 u; S = 32 u; O = 16 u; Na = 23 u; C = 12 u; H = 1 u.
– volume molar 24,5 L/mol, no estado padrão.
Em análises quantitativas, por meio do conhecimento da concentração de uma das espécies, pode-se determinar a concentração e, por conseguinte, a massa de outra espécie. Um exemplo, é o uso do nitrato de prata (AgNO3) nos ensaios de determinação do teor de íons cloreto, em análises de água mineral. Nesse processo ocorre uma reação entre os íons prata e os íons cloreto, com consequente precipitação de cloreto de prata (AgCl) e de outras espécies que podem ser quantificadas.
Analogamente, sais que contêm íons cloreto, como o cloreto de sódio (NaCl), podem ser usados na determinação quantitativa de íons prata em soluções de AgNO3 , conforme descreve a equação:
AgNO3 + NaCl → AgCl + NaNO3
Para reagir estequiometricamente, precipitando na forma de AgCl, todos os íons prata presentes em 20,0 mL de solução 0,1 mol·L-1 de AgNO3(completamente dissociado), a massa necessária de cloreto de sódio será de:
Dados: Massas atômicas: Na = 23 u; Cl = 35,5 u; Ag = 108 u; N = 14 u; O = 16 u.
Observe a reação a seguir.
H2C2O4(aq) + 2OH- (aq) → C2O4- (aq) + 2H2O(I)
Suponha que um técnico em química dissolva em água uma
amostra de 1,0g de ácido oxálico impuro e adicione algumas
gotas de indicador ácido-base. Em seguida, ele titula a
solução com NaOH 0,5M. A amostra consome 40mL da solução de
NaOH até atingir o ponto de equivalência. Qual é a massa de
ácido oxálico na amostra inicial?
Associe as duas colunas relacionando as grandezas com as respectivas unidades de medidas em termos das unidades de base.
(1) Pressão
(2) Energia
(3) Velocidade Angular
(4) Massa Específica
(5) Temperatura
( ) m2 . kg . s-2
( ) kg . m-3
( ) K
( ) m-1 . kg . s-2
( ) s-1
A sequência correta dessa classificação é
A seguinte reação não-balanceada e incompleta ocorre em meio ácido:
(Cr2O7 )-2 + (C2 O4)-2 → Cr3+ + CO2
A soma dos coeficientes estequiométricos da reação completa e balanceada é igual a
