Questões Militares
Sobre interações atômicas: ligações iônicas, ligações covalentes e ligações metálicas. ligas metálicas. em química
Foram encontradas 97 questões
A partir do dia 24 de março de 2021, o Primeiro Batalhão de Bombeiros Militar, em parceria com a Prefeitura de Belo Horizonte, passou a funcionar como um posto fixo para campanha de vacinação contra a Covid-19. As vacinas contra a Covid-19 foram desenvolvidas muito rapidamente e sua constituição química pode variar dependendo da vacina e do fabricante. A vacina da Pfizer, por exemplo, possui em sua constituição, dentre várias substâncias, cloreto de sódio (NaCl), dihidrogenofosfato de potássio (KH2 PO4 ), sacarose (C12H22O11) e fosfato de sódio (Na3 PO4 ).
A respeito das propriedades físico-químicas das substâncias presentes na vacina da fabricante Pfizer, assinale a alternativa correta.
A partir das informações do texto apresentado, julgue o item a seguir, considerando que MH = 1,00 g/mol, MN = 14,00 g/mol, MO = 16,00 g/mol, MP = 31,00 g/mol e MS = 32,00 g/mol.
Os dois compostos apresentados no texto apresentam
ligações iônicas e ligações covalentes.
http://www.crianca.mppr.mp.br/2020/03/233/ESTATISTICAS-Estupro-bate-recorde-e-maioria-das-vitimas-sao-meninas-de-ate-13-anos.html Acesso em 23/06/2020.
Para indicar a presença de esperma, que pode ser encontrado em um crime sexual, podem ser feitos dois testes simples em uma amostra recolhida do fluido biológico da vítima: uma reação utiliza o reativo de Florence, constituído por I2, KI e H2O; a outra, uma solução saturada de ácido pícrico (C6H3N3O7) em glicerina (C3H8O3). Nas duas reações, a presença do esperma é observada devido ao aparecimento de uma coloração amarelada. Embora exista a possibilidade de falsos positivos, estes testes podem ajudar a identificar indícios. A natureza das ligações químicas que formam as substâncias utilizadas nos testes permite classificá-las, respectivamente, como
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

I. O comprimento de ligação e a energia de ligação são influenciados pela multiplicidade da ligação, pela ressonância e pelo raio atômico. II. Cargas formais consideram ligações químicas perfeitamente covalentes ao assumir que os elétrons são igualmente compartilhados. III. O poder de polarização de um cátion é maior quanto maiores forem o seu volume e a sua carga. A interação deste cátion com um ânion altamente polarizável tende a apresentar um maior caráter covalente. IV. Na ressonância há uma diminuição da energia em função da contribuição de estruturas que possuem a mesma geometria, porém com diferentes arranjos dos elétrons.
Das afirmações acima, está(ão) ERRADA(S) apenas
Assinale a alternativa que completa, correta e respectivamente, as lacunas.
O fósforo branco, de fórmula P4, é uma substância bastante tóxica. É utilizado para fins bélicos como arma química de guerra em granadas fumígenas. Pode ser obtido a partir do aquecimento do fosfato de cálcio, areia e coque em um forno especial, conforme mostrado na equação balanceada da reação:
2 Ca3(PO4)2 (s) + 6 SiO2 (s) + 10 C (s) → 6 CaSiO3 (s) + 1 P4 (s) + 10 CO (g)
A respeito da reação de obtenção do fósforo branco, seus participantes e suas características são feitas as seguintes afirmativas.
I – O fósforo branco é classificado como uma substância iônica polar.
II – O fósforo branco (P4 ) é classificado como uma substância simples.
III – A geometria da molécula do gás monóxido de carbono é angular.
IV – A massa de fósforo branco obtida quando se aquece 1860 g de fosfato de cálcio com rendimento de 80% é de 297,6 g.
V – A distribuição eletrônica do átomo de cálcio no estado fundamental é: 1s2 2s2 2p6 3s2 3p5.
Das afirmativas feitas estão corretas apenas
A substância AyXz é um sólido cristalino e sua célula unitária é representada na figura.
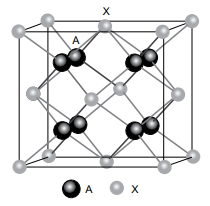
(Morozova, N. V. et al. Journal of Applied Physics. Adaptado)
A fórmula unitária da substância AyXz é
Considere os seguintes pares de compostos iônicos:
I. MgO e MgS.
II. KBr e CaBr2 .
III. MgF2
e CaF2.
Os compostos que apresentam maior energia reticular
em I, II e III, são, correta e respectivamente,
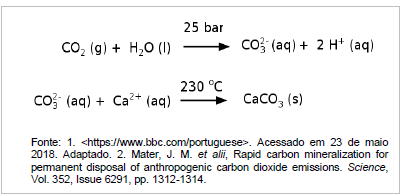
A remoção desse gás da atmosfera ocorre por:
Acerca da espécie química CaWO4 e seus átomos constituintes, são feitas as seguintes afirmativas:
I – No composto CaWO4 o número de oxidação (Nox) do tungstênio é +6. II – O composto CaWO4 é considerado um peróxido. III – O CaWO4 é uma substância que possui apenas ligações do tipo covalente. I V – O tungstênio (Z=74) é um metal de transição externa (“elementos com configuração eletrônica terminando em ns2 (n-1)d1 até 10”). FONSECA, Martha Reis Marques da, Química Geral, São Paulo: Ed FTD, 2007, pág 206.
Das afirmativas feitas estão corretas apenas
( ) A molécula de água é formada por duas ligações covalentes em um ângulo de aproximadamente 105º com o hidrogênio, apresentando assim uma polaridade. E pela existência dessa polaridade, a moléculas de água diferentes são capazes de formar as ligações de hidrogênio. ( ) A formação de ligações de hidrogênio são responsáveis pela alta temperatura de ebulição, se comparado com elementos de seu grupo (ou família), como por exemplo o H2S. ( ) A água se torna menos densa quando congela. ( ) O calor específico da água é baixo, para que ocorra os ciclos hidrológicos na Terra
Assinale a alternativa que apresenta, de cima para baixo, a sequência correta:
I. Átomos de dois elementos diferentes podem possuir afinidades iguais por elétrons. II. A ligação H - Cl possui carga parcial negativa no átomo de cloro. III. Espera-se que a molécula de HF tenha uma maior polaridade que a molécula de HCl. IV. Em ligações do tipo covalente pura, há uma completa transferência de elétrons de um átomo para outro.
Assinale a alternativa que contém as afirmações verdadeiras:
Com relação à química, coloque verdadeiro (V) ou (F) nas afirmativas abaixo, a seguir, a opção correta.
( ) Compostos moleculares são formados por meio de ligações metálicas.
( ) Uma substância formada pela ligação entre um metal e um ametal é iônica.
( ) Na tabela periódica, elementos presentes na coluna 17 tendem a receber elétrons, enquanto que os presentes na coluna 1 tendem a doar elétrons.
( ) A tabela periódica atual foi organizada baseada no número atômico dos elementos.
( ) Os gases nobres são elementos que reagem facilmente com qualquer outro elemento.
( ) Um elemento X- e um elemento Y2+ formarão um composto iônico X2Y.
Analise os complexos abaixo.
I- [Fe(CN)6]4-
II- [Fe(CN)6]3-
III- [Cu(NH3)4]2+
IV- [Cu(CN)4]3-
O número de coordenação em cada um dos complexos acima é, respectivamente: