Questões Militares
Sobre interações atômicas: ligações iônicas, ligações covalentes e ligações metálicas. ligas metálicas. em química
Foram encontradas 97 questões
Com base nas informações acima e na tabela periódica, incluída no final deste caderno de provas, julgue os itens a seguir.
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
A reação do potássio metálico com água forma dois produtos, um de natureza iônica e outro de natureza molecular, os quais apresentam ligações covalentes em sua estrutura.
no início do ano, foi detectada a contaminação do solo, da água e
até de alimentos com isótopos radioativos, como iodo-131 e césio-
137. Sabendo que o iodo-131 emite radiação beta durante a sua
desintegração e tem meia-vida de 8 dias, julgue o seguinte item.

Com base nessas informações e considerando
 a variação de
a variação deentalpia padrão das reações a 25 ºC, julgue os itens a seguir.
Assinale a opção que apresenta, respectivamente, o tipo de ligações que são encontradas na molécula representada pela fórmula N204 e o nome deste composto.
I. A molécula I2 é mais polarizável que Cl2
II. O momento de dipolo de HI é maior que o de HCl.
III. O cátion Na+ é mais polarizante que Li+
IV. O caráter covalente no cloreto de lítio é maior que no cloreto de sódio.
V. As forças intermoleculares entre Cl2 são mais intensas que entre I2-
O esquema a seguir representa de um modo geral, o diagrama de energia para os orbitais moleculares de moléculas diatômicas formadas por elementos do 2° período da tabela periódica.
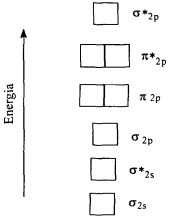
Ao usá-lo para fazer as configurações eletrônicas das espécies químicas N2, O2,
0 2+, F2, e CO, pode-se afirmar que:
Dados
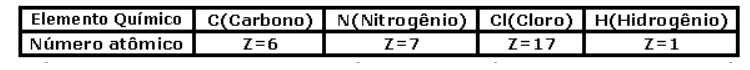
O bicarbonato de sódio é um hidrogenossal que apresenta, em sua estrutura, ligações iônicas e covalentes.
2 Na + 2 H2O → 2 NaOH + H2
Tendo as informações precedentes como referência, assinale a opção correta.

