Questões Militares
Sobre interações atômicas: ligações iônicas, ligações covalentes e ligações metálicas. ligas metálicas. em química
Foram encontradas 97 questões
Com relação a reações químicas e a substâncias, julgue o item subsequente.
Um átomo de carbono pode formar 2, 4 ou 6 ligações com
outro átomo de carbono.
Acerca dos diferentes tipos de ligações químicas e das substâncias formadas em reações químicas, julgue o próximo item.
Em uma ligação covalente, os elétrons são cedidos pelo átomo
de maior tamanho.
Acerca dos diferentes tipos de ligações químicas e das substâncias formadas em reações químicas, julgue o próximo item.
As ligações iônicas são formadas pela união de íons com
cargas iguais.
Com relação ao funcionamento desses tipos de extintores e aos seus componentes químicos, julgue o item a seguir.
A substância do extintor de pó químico é formada por ligações
covalentes e iônicas.
Moléculas de lítio não existem no estado líquido ou sólido, mas, sem dúvida, as moléculas diatômicas são encontradas no lítio gasoso. A energia de ligação do Li2 é 105 kJ/mol.
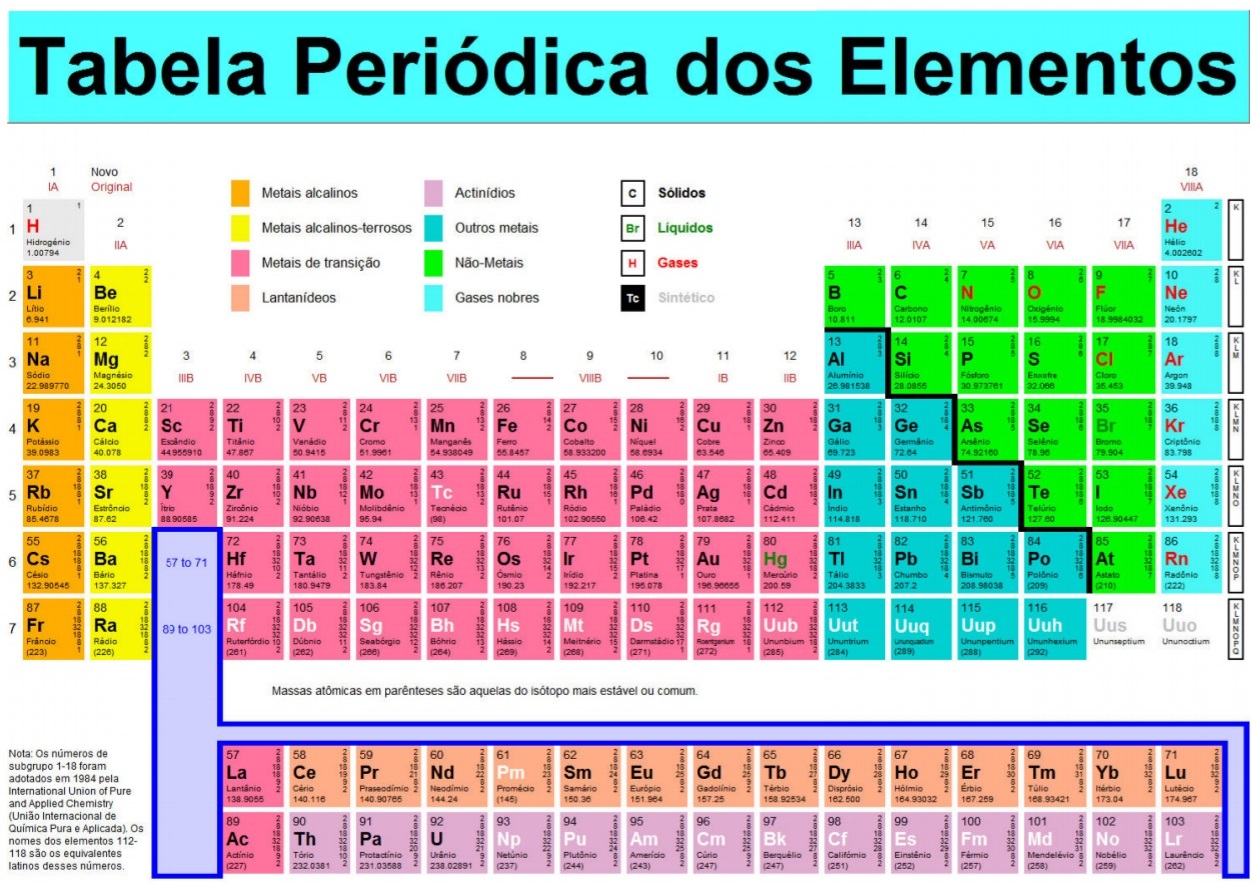
Sobre o diagrama de população da camada de valência do MO para Li2, analise as afirmativas a seguir.
I. A ordem de ligação é 1/2.
II. A configuração eletrônica de Li2 pode ser escrita como KK (σs)2 .
III. A energia de ligação do Li2 é menor do que H2 porque há uma blindagem do núcleo pela camada K completa de cada átomo.
Está(ão) correta(s) apenas a(s) afirmativa(s)
CONSTANTES

DEFINIÇÕES


CONSTANTES

DEFINIÇÕES


I. Alumínio II. Magnésio III. Paládio IV. Sódio V. Zinco
Assinale a opção que apresenta o(s) metal(is) de sacrifício que pode(m) ser utilizado(s).
Os processos de corrosão são considerados reações químicas heterogêneas ou reações eletroquímicas que se passam geralmente na superfície de separação entre o metal e o meio corrosivo. A caracterização da forma de corrosão auxilia bastante no esclarecimento do mecanismo e na aplicação de medidas adequadas de proteção. Relacione as formas de corrosão às suas respectivas características fundamentais e, em seguida, assinale a alternativa que apresenta a sequência correta.
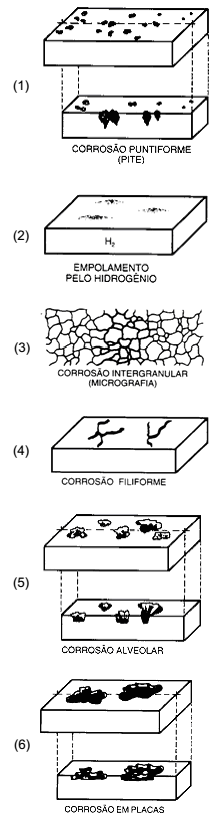
(Gentil, Vicente, 2007)
( ) a corrosão se processa entre os órgãos da rede cristalina do
material metálico.
( ) a corrosão se processa sob forma de finos filamentos, mas não profundos.
( ) o hidrogênio atômico penetra no material metálico, se transforma em hidrogênio molecular, exercendo pressão e originando a formação de bolhas.
( ) a corrosão se processa na superfície metálica produzindo sulcos ou escavações que apresentam fundo arredondado e profundidade geralmente menor que o seu diâmetro.
( ) a corrosão se processa em pontos ou pequenas áreas localizadas na superfície metálica produzindo cavidades que apresentam o fundo de forma angulosa e profundidade geralmente maior do que seu diâmetro.
( ) a corrosão se localiza em regiões da superfície metálica e não em toda sua extensão, formando placas com escavações.
Os espetáculos produzidos por fogos de artifício são resultados de diversas reações químicas. Nos primórdios, as cores desses artefatos estavam limitadas ao dourado e ao prateado por serem estas resultantes da mistura de carvão e limalha de ferro. Em 1786, com a descoberta do clorato de potássio KCℓO3 pelo químico francês Claude Louis Berthollet e, com a disponibilidade dos elementos magnésio e alumínio, o universo de cores dos fogos de artifício ganhou matizes, luminosidade e brilho.
In: Ciência Hoje, v. 48, n.º 288, 2011, p. 27-8 (com adaptações).
Os átomos de um elemento Z cujo número atômico é 20 se unem com os átomos de um elemento Y cujo número atômico é 7 através de uma ligação iônica. Qual a fórmula do composto formado por esses dois elementos?
Os aniontes podem ser divididos em grupos, de acordo com seu comportamento em relação a determinados reagentes.
O grupo volátil são aniontes que, pela adição de ácidos diluídos, não oxidantes, formam produtos gasosos. Assinale a opção em que o anionte pertence ao grupo volátil.
Compostos contendo enxofre estão presentes, em certo grau, em atmosferas naturais não poluídas, cuja origem pode ser: decomposição de matéria orgânica por bactérias, incêndio de florestas, gases vulcânicos etc. No entanto, em ambientes urbanos e industriais, como resultado da atividade humana, as concentrações desses compostos é alta. Dentre os compostos de enxofre, o dióxido de enxofre (SO2) é considerado o mais prejudicial à saúde, especialmente para pessoas com dificuldade respiratória.
(Adaptado de BROWN, T.L. et al, Química a Ciência Central. 9ª ed, Ed. Pearson, São Paulo, 2007)
Em relação ao composto SO2 e sua estrutura molecular, pode-se afirmar que se trata de um composto que apresenta
Dado: número atômico S = 16 ; O = 8