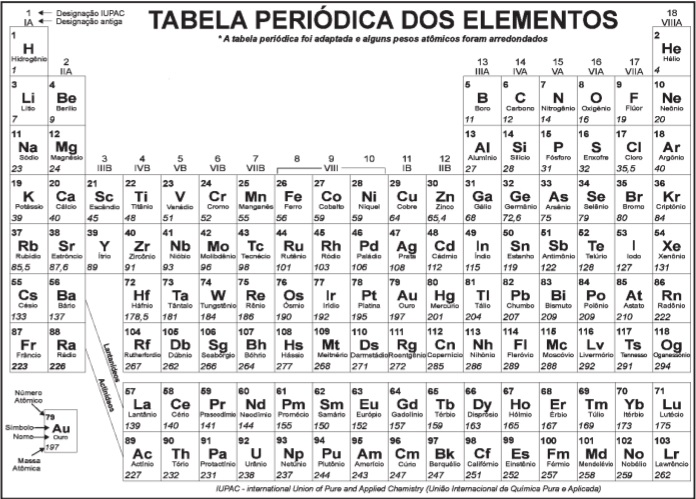
Questões Militares
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 72 questões
Neste caso, podemos afirmar que
Dois cilindros mantidos sob a mesma temperatura contêm gases puros, sendo ozônio no cilindro 1 e dióxido de enxofre no cilindro 2. A capacidade volumétrica do cilindro 2 é igual à metade da capacidade volumétrica do cilindro 1. Os dois gases estão sob a mesma pressão.
A relação entre a massa de gás do cilindro 1 e a massa de gás do cilindro 2 é igual a:
O gás nitrogênio (N2) é o que se encontra em maior proporção no ar atmosférico. Por ser considerado um gás inerte, ele pode estar presente em diversos processos laboratoriais e industriais. Sua obtenção é feita através da liquefação fracionada do ar atmosférico. Supondo que, a partir desse processo, obteve-se uma amostra de 280g desse gás, é correto afirmar que o volume ocupado por ele sob condições normais de temperatura e pressão foi de
Dado: MMN = 14 g/mol
Qual a massa de nitrogênio, em kg?
Considere os dados apresentados na tabela.
Regiões da atmosfera Densidade do ar kg.m–3 Temperatura °C Pressão atm
troposfera 1 17 1
mesosfera 7 x 10–6 –83 X
(Bottecchia, O.L. Química Nova. Adaptado)
Considerando que a massa molar do ar em toda a atmosfera é aproximadamente constante, 29 g.mol–1, o valor
da pressão atmosférica na mesosfera, X, na temperatura
indicada na tabela é aproximadamente
Gases apresentam um fenômeno chamado de difusão de gases.
“Difusão gasosa é o movimento espontâneo das partículas de um gás de se espalharem uniformemente em meio das partículas de um outro gás ou de atravessarem uma parede porosa.
Quando gases diferentes (A e B) estão a uma mesma temperatura, para uma quantidade de matéria igual a 1 mol de gás A e 1 mol de gás B, tem-se que a massa do gás A (ma) será igual à massa molar do gás A (Ma), e a massa do gás B (mb) será igual à massa molar do gás B (Mb).”
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007,
Pág. 110
Considere que, em determinadas condições de temperatura e pressão, a velocidade de difusão de 1 mol do gás hidrogênio (H2) seja de 28 km/min. Nestas mesmas condições a velocidade (em km/h) de 1 mol do gás metano (CH4) é de
Dado: √2 = 1,4
Considere os dados apresentados na tabela.

(Bottecchia, O.L. Química Nova. Adaptado)
Considerando que a massa molar do ar em toda a atmosfera é aproximadamente constante, 29 g.mol–1
, o valor
da pressão atmosférica na mesosfera, X, na temperatura
indicada na tabela é aproximadamente
“Houston, temos um problema” - Esta frase retrata um fato marcante na história das viagens espaciais, o acidente com o veículo espacial Apollo 13. Uma explosão em um dos tanques de oxigênio da nave causou a destruição parcial do veículo, obrigando os astronautas a abandonarem o módulo de comando e ocuparem o módulo lunar, demovendo-os do sonho de pisar na lua nessa missão espacial.
Não foram poucos os problemas enfrentados pelos astronautas nessa missão. Um específico referiu-se ao acúmulo de gás carbônico (dióxido de carbono - CO2) exalado pelos astronautas no interior do módulo lunar. No fato, os astronautas tiveram que improvisar um filtro com formato diferente do usado comumente no módulo. Veículos espaciais são dotados de filtros que possuem hidróxidos que reagem e neutralizam o gás carbônico exalado pelos tripulantes. Para neutralização do gás carbônico, o hidróxido mais utilizado em veículos espaciais é o hidróxido de lítio. Em sua reação com o dióxido de carbono, o hidróxido de lítio forma carbonato de lítio sólido e água líquida.
Considerando o volume de 246 L de gás carbônico produzido pelos astronautas (a 27 ºC e 1 atm), a massa de hidróxido de lítio necessária para reagir totalmente com esse gás é de
Dados: R = 0,082 atm·L·mol-1·K-1
T (Kelvin) = t (Celsius) + 273
Um analista químico realizou um experimento em que utilizou 200 mL de uma solução de concentração 2 mol/L de ácido clorídrico (HCl) para reagir com uma certa massa de bicarbonato de sódio (também denominado de hidrogenocarbonato de sódio). Notou que nem todo o ácido reagiu com essa massa de bicarbonato de sódio, restando um excesso de ácido. Ao final do experimento, ele obteve um volume de 6,15 L de gás carbônico, medidos a 27 ºC e 1 atm. Esse gás carbônico é oriundo da decomposição do ácido carbônico produzido na reação.
Dados: R = 0,082 atm·L·mol-1·K-1
T (Kelvin) = t (Celsius) + 273
Esse analista fez as seguintes afirmativas:
I – A equação química balanceada que descreve corretamente a reação citada é:
Na2CO3 + 2 HCl → H2CO3 + 2 NaCl
II – Para a formação de 6,15 L de CO2, foram consumidos 21 g de bicarbonato de sódio.
III – É uma reação de oxidorredução e o ácido clorídrico é o agente oxidante.
IV – Se todo esse ácido clorídrico fosse consumido numa reação completa com bicarbonato de sódio suficiente, o volume de gás carbônico produzido seria de 9,84 L.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.
Uma amostra de gás metano, CH4, foi aquecida lentamente na pressão constante de 0,90 bar. O volume do gás foi medido em diferentes temperaturas e um gráfico de volume versus temperatura foi construído. Sabendo que inclinação da reta foi 2,88x10-4 L/K, calcule a massa do gás metano e assinale a opção correta.
Dados:
R = 0,082 atm L mol-1 K-1
1 bar = 1 atm
Um técnico em química observou o desprendimento de um gás numa reação química em laboratório e coletou uma amostra para análise. Ao medir a densidade do gás a 25°C e 1,0 atm, ele encontrou o valor de 2,38 g/dm3. Além disso, constatou que o referido gás era composto de 80% de carbono e 20% de hidrogênio em massa. Sendo assim, qual é a fórmula empírica e massa molar do composto gasoso analisado, respectivamente, assumindo que o gás obedece a lei dos gases ideais?
Dados: R = 0,082 atm L mol-1 K-1
Dados: massa atômica de cobre 64 u ; volume molar nas CNTP: 22,7 L
A nitroglicerina é um líquido oleoso de coloração amarela, levemente esverdeada, da classe dos explosivos, substâncias que se decompõem rapidamente, com expansão súbita de gases e grande liberação de energia. Possui massa molecular de 227g.mol-1 e sua temperatura não deve ultrapassar 30°C, nem ser exposta a choques mecânicos. A nitroglicerina é obtida através da nitração da glicerina, utilizando ácido sulfúrico como catalisador. A reação da decomposição da nitroglicerina pode ser escrita como:
4C3 H5 N3 O9(l) → 10H2O(g) + 6N2(g) + O2(g) + 12CO2(g)
Sabendo que a constante dos gases é igual a 8,314J.mol-1.K-1, a decomposição de 227g de nitroglicerina a
27°C e 1,01kPa, vai liberar cerca de quantos litros de gases?
A que temperatura a velocidade média das moléculas de um gás que está a 27°C irá duplicar?
Dado:
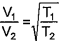
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

Considere um recipiente de 320 L, ao qual são adicionados gases ideais nas seguintes condições:
I. Hélio: 30.000 cm3 a 760 cmHg e 27 °C
II. Monóxido de carbono: 250 L a 1.140 mmHg e - 23°C
III. Monóxido de nitrogênio: 2m3 a 0,273 atm e 0°C
Sabendo que a pressão total da mistura gasosa é de 4,5 atm, assinale a opção que apresenta a pressão parcial do hélio na mistura gasosa.
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1