Questões Militares
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 74 questões
Considere a expansão de um gás ideal inicialmente contido em um recipiente de 1 L sob pressão de 10 atm. O processo de expansão pode ser realizado de duas maneiras diferentes, ambas à temperatura constante:
I. Expansão em uma etapa, contra a pressão externa constante de 1 atm, levando o volume final do recipiente a 10 L.
II. Expansão em duas etapas: na primeira, o gás expande contra a pressão externa constante de 5 atm até atingir um volume de 2 L; na segunda etapa, o gás expande contra uma pressão constante de 1 atm atingindo o volume final de 10 L.
Com base nestas informações, assinale a proposição CORRETA.
I. As partículas dos gases possuem massas desprezíveis. II. As forças entre as partículas dos gases são nulas. III. As colisões entre as partículas são inelásticas. IV. As partículas dos gases têm a mesma energia cinética.
“Gelo de fogo” escondido em permafrost é fonte de energia do futuro? Conhecido como "gelo que arde", o hidrato de metano consiste em cristais de gelo com gás preso em seu interior. Eles são formados a partir de uma combinação de temperaturas baixas e pressão elevada e são encontrados no limite das plataformas continentais, onde o leito marinho entra em súbito declive até chegar ao fundo do oceano. Acredita-se que as reservas dessa substância sejam gigantescas. A estimativa é de que haja mais energia armazenada em hidrato de metano do que na soma de todo petróleo, gás e carvão do mundo. Ao reduzir a pressão ou elevar a temperatura, a substância simplesmente se quebra em água e metano – muito metano. Um metro cúbico do composto libera cerca de 160 metros cúbicos de gás a pressão e temperatura ambiente, o que o torna uma fonte de energia altamente intensiva.
Disponível em: http://www.bbc.co.uk/portuguese/noticias/2014/04/140421_energia_metano_ms.shtml.
Acessado em 21/04/2014. Texto adaptado.
Dado: R = 8,2 x 10-5 m3 atm K-1 mol-1
Para armazenar todo o gás do interior de 1 m3 de “gelo de fogo” num cilindro de 1 m3 e a temperatura de 0°C, é necessária uma pressão (em atm) de
Os exemplos descritos a seguir correspondem às observações realizadas para uma quantidade fixa de matéria de gás e variação de dois parâmetros. Numere as representações gráficas relacionando-as com as seguintes descrições.
1. Ao encher um balão com gás hélio ou oxigênio, o balão apresentará a mesma dimensão.
2. Ao encher um pneu de bicicleta, é necessária uma pressão maior que a utilizada em pneu de carro.
3. O cozimento de alimentos é mais rápido em maiores pressões.
4. Uma bola de basquete cheia no verão provavelmente terá aparência de mais vazia no inverno, mesmo que não tenha vazado ar.
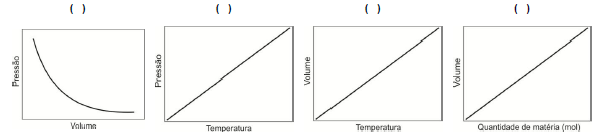
Assinale a alternativa que apresenta a sequência correta na numeração das representações gráficas.
Considere um mol de um gás que se comporta idealmente, contido em um cilindro indeformável provido de pistão de massa desprezível, que se move sem atrito. Com relação a este sistema, são feitas as seguintes afirmações:
I. Se o gás for resfriado contra pressão externa constante, o sistema contrai-se.
II. Se pressão for exercida sobre o pistão, a velocidade média das moléculas do gás aumenta.
III. Se o sistema for aquecido a volume constante, a velocidade média das moléculas aumenta, independentemente da natureza do gás.
IV. A velocidade média das moléculas será maior se o gás for o xenônio e menor se for o argônio.
Das afirmações acima, está(ão) ERRADA(S) apenas
A atmosfera artificial de um submarino pode ser considerada um gás ideal. Considere que, ao submergir, a temperatura interna do submarino sofreu 25% de redução em relação ao valor inicial na superfície e que a pressão da água do mar sobre o casco era o dobro da pressão na superfície. Assinale a opção que corresponde à variação da pressão interna que foi compensada para manter o ambiente interno desse submarino à pressão constante.
Dado: P.V = n.R.T
Dados:
Massas Atômicas: C = 12 u; O = 16 u e H = 1u;
Volume molar nas condições padrão=24,5 L·mol-1 .
Uma amostra de gás metano (CH4) foi aquecida, lentamente, na pressão constante de 0,90 bar. O volume de gás foi medido em diversas temperaturas e um gráfico de volume versus temperatura foi construído. Sabendo que o valor da inclinação da reta encontrado para o citado gráfico foi de 2,88 x 10-4 L.K-1 , qual é o valor correspondente à massa do gás metano?
Dados:
1) Considerar o gás metano como ideal; e
2) R = 8,314 x 10-2 L.bar.K-1 . mol-1
Uma nova mania na Europa consiste em "consumir" oxigênio puro. As embalagens são latas exclusivas com inalador em forma de copo, são fabricadas na Suíça e contêm 99,5% de oxigênio. Basta pressionar o copo inalador contra a vasilha para liberar oxigênio e respirar.
Este sistema, chamado de OXYFIT, não é um sistema de liberação contínua do gãs, mas libera o oxigênio a cada inalação.
Consumido em alguns países da América do Norte e da Europa, este produto, chamado de Opur, é vendido em embalagens de 2 litros que contêm o equivalente a 10-15 inalações, em média. Mas há também versões de 5 e de 8 litros, esta última contendo 160 gramas do gãs. Os preços variam de US$ 10 a US$ 32 a garrafa.
Considerando os dados acima e sabendo que a massa molar do oxigênio (02) é igual a 32 g/mol, assinale a opção que apresenta corretamente o número de mols de gãs oxigênio, contidos numa embalagem de 8 litros de Opur, e a densidade do conteúdo, respectivamente.
Um volume V1 de oxigênio e um volume V2 de ácido sulfídrico, ambos nas mesmas condições de temperatura e pressão, são misturados. Promovendo-se a reação completa, verifica-se que os produtos da reação, quando colocados nas condições iniciais de pressão e temperatura, ocupam um volume de 10 L.
Considere que a água formada encontra-se no estado líquido e que as solubilidades dos gases em água são desprezíveis. Sabendo-se que havia oxigênio em excesso na reação e que V1 + V2 = 24 L, verifica-se que o valor de V2 é: