Questões Militares
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 74 questões
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

Um recipiente contém cerca de 3 mols de um gás a 27°C, em uma pressão de 1,5 atm. Após a abertura deste recipiente, o gás passa a sofrer pressão de 0,9 atm. Assinale a alternativa que corresponde ao volume do gás, em L, dentro do recipiente após a abertura.
(Dados: R = 0,082 atm. L / mol . K.)
Analise as afirmativas a seguir.
I. Com a temperatura sendo mantida constante, a massa de um determinado gás ocupa um volume diretamente proporcional à sua pressão.
II. Com a pressão sendo mantida constante, a massa de determinado gás ocupa um volume diretamente proporcional à sua temperatura termodinâmica.
III. Com o volume sendo mantido constante, a pressão exercida pela massa de determinado gás é diretamente proporcional à sua temperatura termodinâmica.
Estão corretas as afirmativas
“Certo gás em temperatura de 27°C e 1 atm, dentro de um recipiente isotérmico, sofreu uma variação em sua pressão, passando a ser 1,5 atm.”
Assinale a alternativa que corresponde à quantidade de mols existente dentro do recipiente.
(Dados: V = 22,4L; R = 0,082 atm. L / mol . K.)
A nitroglicerina é um líquido oleoso de cor amarelo-pálida. É altamente sensível ao choque. O simples ato de balançar o líquido pode causar a explosiva decomposição em gases de nitrogênio, dióxido de carbono, água e oxigênio. A equação química abaixo representa essa reação.
4C3H5N3O9 (l ) → 6N2 (g ) + 12CO2 (g ) + 10H2O (g ) + O2 (g )
Calcule o volume de gases CO2 produzido quando uma amostra de 200 gramas de nitroglicerina é detonada. Considere os seguintes dados: Massa g/mol: H = 1; C = 12; N = 14; O = 16; Constante universal dos gases: R = 8,2 · 10−2 atm · L · K−1 · mol−1; Pressão: 1 atm; Temperatura: 27°C e Volume Molar: 22,4 L . mol-1.
Mediante análise, marque a alternativa que apresenta corretamente o volume aproximado.
Em muitos aspectos, os gases são a forma de matéria mais facilmente entendida. Ainda que diferentes gases possam ter diferentes propriedades químicas, eles se comportam de maneira bastante similar no que concerne às propriedades físicas. De acordo com o exposto, analise as afirmativas a seguir.
I. A densidade do vapor de tetracloreto de carbono a 714 torr e 125°C é 4,43 g/L.
II. A razão entre as taxas de efusão de N2 e O2 é 0,93.
III. A velocidade vqm, u, de uma molécula de N2 a 25°C é 5,15 x 102 m/s.
Está(ão) correta(s) apenas a(s) afirmativa(s)
CONSTANTES

DEFINIÇÕES


CONSTANTES

DEFINIÇÕES


A explosão de 8,8 L de trinitroglicerina (TNG, d = 1,59 g/m L) que ocorreu com 100% de rendimento, pode ser expressa pela equação química a seguir:
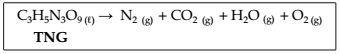
Supondo que todo o gás carbônico produzido possa
ser captado, quantos extintores de incêndio com
capacidade para 2 kg desse gás, poderiam ser
envasados aproximadamente?
I. As partículas em um gás interagem entre si apenas quando as colisões ocorrem.
II. A energia cinética média das partículas em um gás é proporcional à temperatura absoluta do gás e depende da identidade do gás.
III. As partículas em um gás movem‐se em linhas retas, exceto quando elas colidem com outras moléculas ou com as paredes do recipiente. As colisões entre si e com as paredes do recipiente são elásticas, de tal forma que a energia cinética das partículas é conservada.
Está(ão) correta(s) a(s) afirmativa(s)
Dados: massa molar da nitroglicerina = 227 g/mol; volume molar = 24,5 L/mol (25 ºC e 1 atm)
Dado: R = 8,314kPa dm3 mol -1 K -1