Questões Militares
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 57 questões
N2(g) + O2(g) ⇌ 2NO(g) K1 2NO(g) + O2(g) ⇌ 2NO2(g) K2
NO2(g) ⇌ 1/2 N2(g) + O2(g) K3
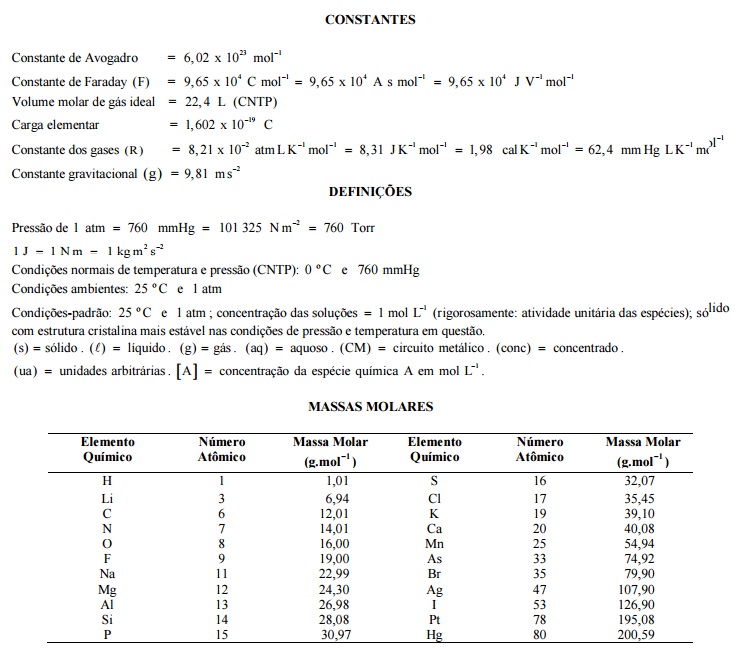
A análise dos dados termodinâmicos de reações permite a previsão da espontaneidade. Na tabela a seguir estão apresentados os dados termodinâmicos de duas reações químicas.
A partir dos dados apresentados, identifique as seguintes afirmativas como verdadeiras (V) ou falsas (F):
( ) A diminuição da temperatura desfavorece a espontaneidade da reação (i).
( ) O aumento da temperatura favorece a espontaneidade da reação (ii).
( ) Na temperatura de 400 K, a reação (i) será espontânea.
( ) Na temperatura de 4000 K, a reação (ii) será espontânea.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
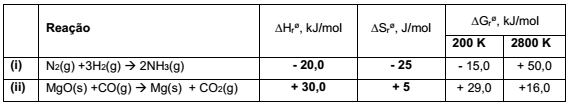
Recentemente, a produção fotocatalítica de hidrogênio vem atraindo atenção devido ao processo que gera um combustível limpo, o qual é utilizado em células a combustível. O processo se baseia na separação da água nos seus componentes, conforme equilíbrio inserido no esquema, utilizando luz solar e um fotocatalisador (p. ex. NaTaO3:La). O processo é extremamente endotérmico, necessitando 1,23 eV para ocorrer. Num experimento, o processo foi realizado num sistema fechado, como esquematizado abaixo. Considerando essas informações, identifique as afirmativas a seguir como verdadeiras (V) ou falsas (F):
( ) A quantidade de fotocatalisador limita a conversão.
( ) O aumento da temperatura irá favorecer a conversão.
( ) A diminuição do volume do sistema irá favorecer a conversão.
( ) É condição necessária para a produção de hidrogênio que o fotocatalisador absorva energia solar superior a 1,23 eV.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
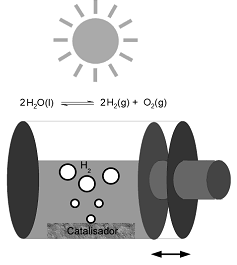
Num ensaio em laboratório, foram acondicionados num sistema fechado N2(g), O2(g), NO2(g) e vapor de água que está em equilíbrio com água líquida. A partir desses dados, considere as seguintes afirmações:
1. O aumento na pressão total do sistema tenderá a diminuir o pH da solução dentro do sistema.
2. Um aquecimento brando tenderá a aumentar o pH da solução dentro do sistema.
3. A adição de excesso de água líquida no sistema tenderá a deslocar o equilíbrio, diminuindo o pH da solução dentro do sistema.
4. A contribuição do ácido nitroso (HNO2) para o pH da solução dentro do sistema é desprezível.
Assinale a alternativa correta
Indicadores de pH são substâncias orgânicas de caráter fracamente ácido ou básico, que têm a propriedade de mudar de coloração com a variação do pH do meio. A faixa dentro da qual se processa a mudança de coloração de um indicador é conhecida como zona de transição.
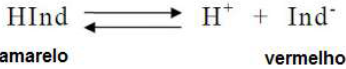
A solução que se torna amarela com a adição desse indicador é a solução de
 C(g) + 2 D(g) foram levantados os seguintes dados:
C(g) + 2 D(g) foram levantados os seguintes dados: 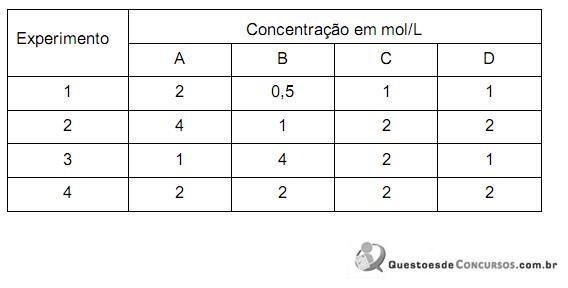
Dos experimentos realizados, um ainda não atingiu o equilíbrio.
O experimento que NÃO atingiu o equilíbrio é o
Observe a reação química abaixo.

Sabendo que a reação química acima se processa a volume
constante, é correto afirmar que para aumentar a obtenção de
gás nitrogênio, deve-se
Observe a reação química a seguir.
CS2 (g) + 4H2 (g)  CH4 (g) + 2H2S
CH4 (g) + 2H2S
Em relação à reação química acima, assinale a opção que
apresenta a relação correta entre a lei da ação das massas,
as concentrações molares e a constante de equilíbrio da reação.

A respeito dessa reação, são feitas as seguintes afirmações:
I – a reação direta trata-se de um processo exotérmico;
II – o denominador da expressão da constante de equilíbrio em termos de concentração molar (Kc) é igual a [H2O]·[C];
III – se for adicionado mais monóxido de carbono (CO(g)) ao meio reacional, o equilíbrio será deslocado para a esquerda, no sentido dos reagentes;
IV – o aumento na pressão total sobre esse sistema não provoca deslocamento de equilíbrio.
Das afirmações feitas, utilizando os dados acima, está(ão) correta(s):
São descritos três experimentos (I, II e III) utilizando-se em cada um 30 mL de uma solução aquosa saturada, com corpo de fundo de cloreto de prata, em um béquer de 50 mL a 25 °C e 1 atm:
I. Adiciona-se certa quantidade de uma solução aquosa 1 mol.L−1 em cloreto de sódio.
II. Borbulha-se sulfeto de hidrogênio gasoso na solução por certo período de tempo.
III. Adiciona-se certa quantidade de uma solução aquosa 1 mol.L−1 em nitrato de prata.
Em relação aos resultados observados após atingir o equilíbrio, assinale a opção que apresenta o(s)
experimento(s) no(s) qual(is) houve aumento da quantidade de sólido.
H2O(g) + C(s) + 31,4 kcal ⇄ CO(g) + H2(g)
pode-se afirmar que:
NaCℓO (aq) + H2O (l)
 HCℓO (aq) + Na+ (aq) + OH -(aq)
HCℓO (aq) + Na+ (aq) + OH -(aq)
Nesse equilíbrio, o ácido hipocloroso consegue atravessar as paredes celulares de bactérias e reagir com outras moléculas proteicas existentes dentro desses microorganismos. Desse modo, esse ácido atua como desinfetante, germicida e bactericida.
Analisando a equação do equilíbrio e a ação do ácido hipocloroso, é CORRETO afirmar que

I. a reação direta representada em (a) é a mais espontânea.
II. a reação representada em (c) apresenta maior constante de equilíbrio.
III. a reação inversa mais espontânea é aquela representada em(b).
IV. no equilíbrio, a menor concentração de Cl2(g) será em (c).
V. no equilibrio, o produto em maior concentração é o da reação (a).
Das afirmações acima, são verdadeiras:
I. Segundo o princípio de Le Châtelier a adição de H+ ao sistema tampão faz liberar mesma quantidade de OH-.
II. O sistema tampão funciona no sistema digestivo, mas não no sistema sanguíneo.
III. Por adição do sal à solução do ácido para formar o tampão, a percentagem de dissociação do ácido diminui.
IV. A solução tampão sofre pequena variação de pH quando a ela são adicionados íons H+ ou OH-.
Em cinco béqueres foram adicionados 50 mL de uma solução de referência, que consiste de uma solução aquosa saturada em cloreto de prata, contendo corpo de fundo, a 25 °C e 1 atm. A cada béquer, foram adicionados 50 mL de uma solução aquosa diluída diferente, dentre as seguintes:
I. Solução de cloreto de sódio a 25 °C.
II. Solução de Glicose a 25 °C.
III. Solução de Iodeto de sódio a 25 °C.
IV. Solução de Nitrato de prata a 25 °C.
V. Solução de Sacarose a 50 °C.
Considere que o corpo de fundo permanece em contato com as soluções após rápida homogeneização das
misturas aquosas e que não ocorre formação de óxido de prata sólido. Nestas condições, assinale a opção que
indica a(s) solução(ões), dentre as acima relacionadas, que altera(m) a constante de equilíbrio da solução de
referência.