Questões Militares
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 57 questões

Gás metano pode ser convertido em gás hidrogênio a partir do seguinte equilíbrio:

À temperatura de 500 ºC, para as pressões parciais de CH4(g) de 4 atm, H2O(g) de 4 atm e de H2(g) de 2 atm, em um sistema com volume de 100 L e considerando a constante geral dos gases R = 0,0831 atm.L.mol-1.K-1, a massa de CO(g) no equilíbrio é aproximadamente:
Um procedimento para obtenção de estanho metálico foi realizado a partir do óxido de estanho (IV), em um compartimento selado que, após ser evacuado, foi preenchido com gás hidrogênio. Ao ser atingido o equilíbrio químico a 900 K, a atmosfera gasosa no interior do compartimento era composta por 45% gás hidrogênio, em volume.
A constante de equilíbrio, Kp, para essa reação a 900 K é igual a, aproximadamente,


2A + B ⇆ C + D + Q
em que A e B são reagentes, C e D os produtos e Q o calor liberado. Avalie as seguintes suposições sobre o efeito das modificações de um parâmetro da reação, mantendo os outros constantes.
I. Conduzir a reação a 600 °C gera uma fração maior de C e D.
II. Conduzir a reação a 600 °C faz com que o equilíbrio seja alcançado em menos de 60 min.
III. Conduzir a reação a uma pressão de 100 atm gera uma fração menor de C e D.
IV. Remover C e D do meio reacional após o equilíbrio e então retomar a reação permitem obter uma fração total maior de C e D.
Escolha a opção que lista a(s) afirmação(ões) CORRETA(S).
Visando estudar o equilíbrio a seguir, um experimentador adicionou quantidades equimolares de tricloreto de fósforo e cloro gasoso em um reator a 180 °C.
PCl3(g) + Cl2(g) ⇌ PCl5(g)
Atingido o equilíbrio, foi verificada uma concentração de 1 x 10−4 mol/L de pentacloreto de fósforo.
Admitindo que, a 180 °C, a constante do equilíbrio em apreço
seja igual a 0,64, assinale a opção que indica a concentração de
cloro gasoso presente no equilíbrio.
Industrialmente, o PCl5 é sintetizado em reator fechado por meio da cloração do PCl3, de acordo com a equação química a seguir.
PCl3(g) + Cl2(g) ⇌ PCl5(g) ΔH = −124 kJ/mol
Conforme o princípio de Le Châtelier, o rendimento desse
processo pode ser aumentado
Uma das atividades em que os militares do Corpo de Bombeiros precisam atuar com muita sabedoria é no combate ao incêndio. A exposição dos militares bombeiros ainda é maior em incêndios florestais, uma vez que o uso de equipamentos de proteção fica limitado e os riscos de intoxicação pela fumaça contendo monóxido de carbono são eminentes. O monóxido de carbono tem habilidade de se ligar muito fortemente a hemoglobina (Hb), uma proteína que contém ferro nas células de glóbulos vermelhos. Nessa ligação, forma-se o complexo carboxihemoglobina (COHb). A ligação do oxigênio com a hemoglobina forma a oxihemoglobina(O2Hb).
A respeito do texto descrito, considere o seguinte equilíbrio:
O2Hb (aq) + CO (g)⇌COHb (aq) + O2 (g) K > 1
Do ponto de vista do equilíbrio químico, quando o indivíduo respira muito monóxido de carbono,
2 SO2 (g) + O2(g) ⇌ 2 SO3(g) Temperatura, K Constante, Kc 300 4 x 1024 500 2,5 x 1010 700 3,0 x 104
As melhores condições para que a formação do produto seja favorecida são:

As melhores condições para que a formação do produto seja favorecida são:
Os principais parâmetros que definem a qualidade da água de uma piscina são o pH e a alcalinidade. Para a água ser considerada própria, o pH deve ser mantido próximo de 7,0, para garantir o conforto do banhista e a eficácia dos agentes bactericidas. Já a alcalinidade, expressa em concentração de íon bicarbonato, deve ser em torno de 100 g m-3 . A propriedade anfotérica desse íon garante que qualquer substância ácida ou básica introduzida seja prontamente neutralizada, conforme mostram as equações químicas abaixo:
HCO3 - (aq) + H+ (aq) ⇄ H2O(l) + CO2(g)
HCO3 - (aq) + OH- (aq) ⇄ H2O(l) + CO3 2- (aq)
Ao adicionar carbonato de sódio na água de uma piscina, que está em condições consideradas adequadas para o banho, ocorrerá:
I. O aumento da pressão no reator, mediante adição de um gás inerte, aumenta o rendimento do processo. II. O uso de um catalisador mais efetivo aumenta o rendimento do processo. III. Uma vez atingido o equilíbrio, não ocorrem mais colisões efetivas entre moléculas de H2(g) e N2(g). IV. Considerando que ainda exista superação da energia de ativação, a redução da temperatura no reator diminui a velocidade da reação, mas favorece a formação de amônia.
Assinale a opção que apresenta a(s) afirmação(ões) CORRETA(S) sobre a reação de formação da amônia.
Anodo, H2 → 2H+ + 2e- (E° = 0 V) Catodo, Br2 + 2e- → 2Br- (E° = 1,087 V)
A dissociação da água pode ser observada pelo efeito da seguinte semirreação:
O2 + 4e-+ 4H+ → 2H2O E° = 1,229 V
A formação de complexos iônicos de polibrometo ocorre segundo as reações e suas respectivas constantes de equilíbrio:
Br2 + Br- ⇌ Br3- K3 = 16,7 2Br2 + Br- ⇌ Br5- K5 = 37,7
Sejam feitas as seguintes afirmações a respeito dessa bateria:
I. O potencial da célula pode ser aproximado pela equação: Ecatodo - Eanodo = 1,087 + 0,06 pH. II. O solvente (água) é termodinamicamente estável somente a pH < 2,4.
III. Recarregar a bateria com um potencial catódico inferior a 1,229 V garante a estabilidade do solvente. IV. Durante a descarga da bateria, a concentração do HBr aumenta e podem formar complexos ionicos de Br3- e Br5-.
Das afirmações acima, estão CORRETAS
A síntese do trióxido de enxofre é um processo exotérmico

A dependência da constante de equilíbrio (Keq) com a temperatura é dada pela equação de van’t Hoff
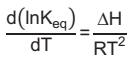
em que Keq é a constante de equilíbrio, ΔH é a entalpia da reação, R é a constante universal dos gases
(R = 8,3 J.mol-1.K-1) e T é a temperatura. Sabendo-se que Keq (300 K)=1 e considerando-se a entalpia da
reação aproximadamente constante nessa faixa de temperatura, o aumento da temperatura da reação de
20 °C desloca o equilíbrio da reação no sentido de formação dos
A adsorção é um fenômeno de superfície no qual espécies em fase líquida ou gasosa, chamadas adsorvatos, ligam-se à superfície do adsorvente por meio de interações físicas, químicas ou ambas. Além da catálise heterogênea, a adsorção também é aplicada à purificação de gases e a o tratamento de efluentes líquidos, entre outros usos. Para determinar o grau de recobrimento da superfície do adsorvente, como uma função da concentração do adsorvato no meio líquido ou gasoso, à temperatura constante, são estabelecidas as isotermas de adsorção.
O processo de adsorção pode ser representado por meio da seguinte equação
A + S ⇌ AS
em que A é o adsorvato, no estado líquido ou gasoso, S representa o sítio vazio na superfície do adsorvente e AS representa o sítio ocupado por A na superfície do adsorvente.
A adsorção de ácido acético em carvão ativado pode ser descrita pela isoterma de Freundlich, expressa pela seguinte equação
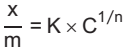
em que x é a massa de material adsorvido, m é a massa de material adsorvente, K e n são as constantes
do modelo e C é a concentração da solução (g.L-1) no equilíbrio. Os dados de equilíbrio para a adsorção de
ácido acético, a partir de soluções aquosas, em carvão ativado, são apresentados na figura a seguir.
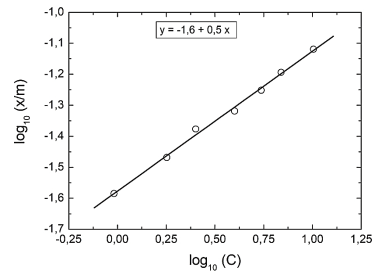
A partir dos dados apresentados no gráfico, é correto afimar que os valores das constantes K e n são,
respectivamente,
Um profissional do Corpo de Bombeiros Militar atua em diversas áreas de proteção e segurança da sociedade. Inicialmente, suas funções eram apenas de contenção e extinção de incêndios. Com o tempo, suas funções foram redefinidas, tornando-se um profissional responsável pela preservação do patrimônio ameaçado de destruição, salvamentos e conscientização civil das medidas básicas de segurança. Uma das áreas de atuação do Corpo de Bombeiros Militar é o salvamento em alturas, atividade de grande risco desenvolvida em locais de altitudes. O grande problema em atuar nessas áreas é que o indivíduo pode ficar sujeito a indisposição, dores de cabeça, náusea e cansaço devido ao ar rarefeito.
A equação química a seguir representa um sistema em equilíbrio envolvido na transformação da hemoglobina (Hm) em oxiemoglobina (HmO2 ) no sangue:
Hm (aq) + O2 (aq) ⇋ HmO2 (aq)
Sobre o processo de transformação de hemoglobina em oxiemoglobina na ação do profissional bombeiro em diferenças
de altitudes, assinale a alternativa incorreta.
O sulfito de sódio (Na2SO3 ) é um sal inorgânico muito utilizado como conservante de alimentos e na manufatura de papel. Um dos processos de produção do sulfito de sódio pode ser obtido mediante a seguinte equação na condição de equilíbrio químico.
Na2O(s) + SO2(g) ⇋ Na2SO3(s) ∆H < 0
Considerando que para a reação de produção em um processo industrial é desejável que se produza
mais sulfito de sódio partindo de um sistema em equilíbrio, qual fator é adequado para tal processo?
Analise o seguinte equilíbrio:

Suponha que o valor da constante de equilíbrio é 300 a
600 K, e que a concentração das quatro espécies inicia-se
a 0,100 mol/L. Assinale a opção que apresenta de que
maneira essas concentrações mudarão, à medida que o
sistema se aproxima do equilíbrio, se a temperatura for
mantida a 600 K.