Questões Militares
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 57 questões
Constantes de equilíbrio de ácidos fracos a 25 oC

Com base nas informações fornecidas, qual dos sais indicados a seguir é o mais eficiente como solução neutralizante?
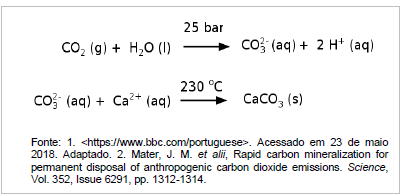
A remoção desse gás da atmosfera ocorre por:
Analise a seguinte reação.
2NO2(g) ⇄ N2O4(g) ΔH = -57,2 kJ/mol
Na reação acima, o equilíbrio se desloca para a esquerda
quando, considerando conjuntamente os efeitos da
compressão e temperatura sobre o sistema:
Dadas as seguintes equações que representam supostas reações químicas irreversíveis em meio aquoso e temperaturas moderadas:
I) 6 HBr + 2 Al → 2 AlBr3 + 3 H2
II) H2SO4 + BaCl2 → BaSO4 + 2 HCl
III) 2 KOH + NiSO4 → Ni(OH)2 + K2SO4
IV) 2 HBr + K2S → 2 KBr + H2S
V) BaCl2 + Na2CO3 → BaCO3 + 2 NaCl
Pode-se afirmar que a reação:
A hidrazina é um composto químico cuja fórmula química é N2H4 . Ela é usada, entre outras aplicações, como propelente para satélites artificiais, para produção de produtos químicos da agricultura e como removedor de oxigênio de caldeira. Usualmente, uma de suas principais reações conhecidas é a liberação dos gases quentes, quando em contato com um oxidante.
Considere a reação:
2N2H4(l) + N2O4(l) ↔ 3N2(g) + 4H2O(g) ΔH = -1094KJ
Interpretando a reação acima, o equilíbrio da reação desloca-se no sentido dos produtos
A afirmativa a seguir contextualiza a questão. Leia‐a atentamente.
“A corrosão é a deterioração de um material, geralmente metálico, por ação química ou eletroquímica do meio ambiente associada ou não a esforços mecânicos.”
(GENTIL, V. corrosão. LTC. 6ª ed. 2012.)
Analise a reação a seguir com seus respectivos sentidos:
• Mn+ + e– → M (sentido 1).
• M → Mn+ + e– (sentido 2).
Considerando o princípio de Le Châtelier, o equilíbrio da reação será influenciado no sentido 1 de acordo com qual
alternativa?
Considere a reação, em equilíbrio, de produção do alvejante gasoso dióxido de cloro, que ocorre em um sistema reacional:
Cl2(g) + 2 NaClO2(s) ⇄ 2 ClO2(g) + 2 NaCl(s)
Nessa situação, assinale a alternativa correta.
Os corais fixam-se sobre uma base de carbonato de cálcio (CaCO3), produzido por eles mesmos. O carbonato de cálcio em contato com a água do mar e com o gás carbônico dissolvido pode estabelecer o seguinte equilíbrio químico para a formação do hidrogenocarbonato de cálcio:
CaCO3 (s) + CO2 (g) + H2O (l) 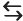 Ca(HCO3)2 (aq)
Ca(HCO3)2 (aq)
Considerando um sistema fechado onde ocorre o equilíbrio químico da reação mostrada acima,
assinale a alternativa correta.
Considere que o pH estomacal seja igual a 2. Quando o fármaco ácido acetilsalicílico (AAS) é ingerido, no estômago sofre ionização em meio aquoso, estabelecendo o seguinte equilíbrio:
AAS(s) + H2O(l)  H3O+(aq) + AAS–(aq) ΔH < 0
H3O+(aq) + AAS–(aq) ΔH < 0
Nessas condições, é CORRETO afirmar que a ionização do AAS é:
H+ (aq) + HCO– 3(aq)↔ H2CO3(aq) ↔ H2O(l) + CO2(g)
A regulagem do pH do plasma sanguíneo relaciona‐se diretamente ao transporte efetivo de O2 para os tecidos corpóreos. O oxigênio é carregado pela proteína hemoglobina encontrada nas células de glóbulos vermelhos. A hemoglobina (Hb) liga‐se reversivelmente tanto ao H+ quanto ao O2.
HbH+ + O2↔ HbO2 + H+
De acordo com as reações apresentadas, marque V para as afirmativas verdadeiras e F para as falsas.
( ) Durante períodos de esforço vigoroso grandes quantidades de CO2 são produzidas pelo metabolismo, que desloca o equilíbrio para a direita, diminuindo o pH.
( ) Quando o sangue atinge os tecidos nos quais a concentração de O2 é baixa, o equilíbrio desloca‐se para a esquerda e O2 é liberado.
( ) Durante períodos de esforço vigoroso, à medida que O2 é consumido, o equilíbrio desloca‐se para a direita de acordo com o princípio de Le châtelier.
( ) A remoção de CO2 por exalação desloca o equilíbrio para a direita, consumindo íons H+ .
A sequência está correta em
( ) A quantidade de fotocatalisador limita a conversão. ( ) O aumento da temperatura irá favorecer a conversão. ( ) A diminuição do volume do sistema irá favorecer a conversão. ( ) É condição necessária para a produção de hidrogênio que o fotocatalisador absorva energia solar superior a 1,23 eV.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
Considere a seguinte reação reversível de dissociação de um ácido fraco.
HA <-> H+ + A-
Sabendo-se que o grau de ionização desta reação é 0,5 e que
antes do início da dissociação a concentração de ácido era de 1mol/l. Assinale a opção que apresenta o valor da constante
de equilíbrio.
Considere a reação reversível à seguir.
A + B <-> C + D
Sabendo-se que a notação [x] indica a concentração de um
determinado componente x, assinale a opção que apresenta o
valor da constante de equilíbrio da reação.
Com relação ao equilíbrio das reações químicas, analise as afirmativas abaixo.
I - A expressão matemática da constante de equilíbrio (K) relaciona as concentrações de reagentes e produtos no equilíbrio.
II - Os efeitos da perturbação de um equilíbrio químico são previstos pelo Princípio de Le Chatelier.
III- Quando o valor da constante de equilíbrio for grande (K muito maior que 1), a reação é favorável aos reagentes e as concentrações dos produtos no equilíbrio são menores que as dos reagentes.
Assinale a opção correta.
Marque a opção correta.
Para a reação representada abaixo, a constante de equilíbrio, Keq, é descrita como:

Considere as duas reações representadas a seguir:
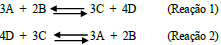
Se Keq para a reação 1 é igual a 0,1, qual é o Keq para a reação 2?