Questões Militares
Sobre substâncias inorgânicas: dissociação iônica e ionização, conceitos de ácido-base. em química
Foram encontradas 77 questões
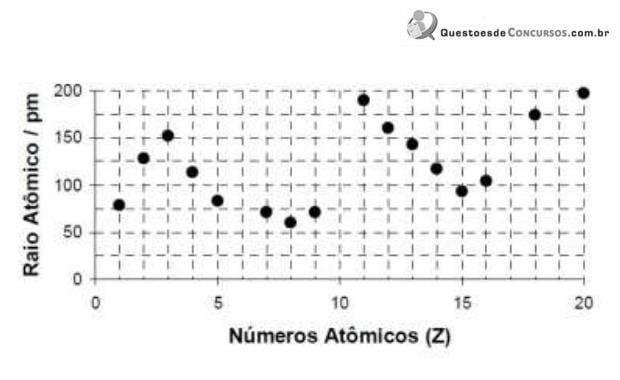
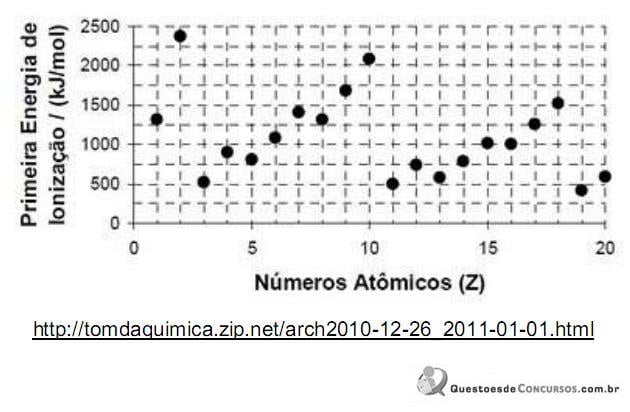
A explicação para o fato de a primeira energia de ionização do elemento sódio ser menor do que a do elemento fósforo é:
Com base nas informações acima e na tabela periódica, incluída no final deste caderno de provas, julgue os itens a seguir.
A notícia publicada neste ano trata de um projeto de mineração de potássio. Sobre esse elemento, analise as afirmativas a seguir:
1. É um metal.
2. Soluções salinas de seus haletos costumam ser levemente alcalinas.
3. Na mineração, é extraído como substância simples de águas de lagos e rios.
4. Sua principal aplicação é em fertilizantes, onde é o terceiro macronutriente da sigla NPK.
Assinale a alternativa correta.
Considere a reação do tetraborato de sódio:
Na2B4O7 . 10H2O(s) + H2SO4(aq) → 4B(OH)3 (aq ) + Na2 SO4(aq ) + 5H2O (ℓ)
Em relação ao produto da reação B(OH)3 são feitas as seguintes afirmações:
I. B(OH)3 é um ácido de Brönsted – Lorry.
II. B(OH)3 é uma base de Arrhenius.
III. O produto da primeira ionização do B(OH)3(aq) é o BO(OH)−2 (aq).
Das afirmações acima, está(ão) CORRETA(S) apenas
Dado Kps(MX) = 5 x 10─12.
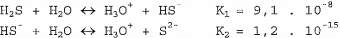
A constante de ionização total da reação pode ser expressa pela relação:
A concentração de um solvente em um processo que ocorre em solução aquosa e do qual a água participa como reagente irá variar de acordo com a quantidade de soluto da solução: quanto mais soluto, menor a concentração do solvente (1ª parte). A água mineral de locais onde exista calcário é alcalina devido à presença de CaCO3 (Carbonato de Cálcio) dissolvido, presente no calcário, que, ao sofrer hidrólise salina, deixa o meio básico (2ª parte).
A sentença está:
O bicarbonato de sódio pode ser classificado como sal
Observe a equação abaixo.
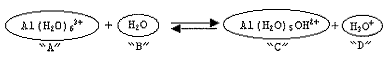
Com base na definição de ácidos e bases de Bronsted-Lowry, é
correto afirmar que os compostos acima "A", "B", "C" e "D"
são, respectivamente:
I – MgO II – CO III – CO2 IV – CrO3 V – Na2O
Os óxidos que, quando dissolvidos em água pura, reagem produzindo bases são
Analise as equações a seguir.
I - HF + H2O → H3O+ + F-
II - HCl + NH3 → NH4+ + Cl-
III- HNO3 + H2O → H3O+ + NO3-
De acordo com o conceito de ácido-base de Bronsted-Lowry, é INCORRETO afirmar que na equação
