Questões Militares
Sobre substâncias inorgânicas: dissociação iônica e ionização, conceitos de ácido-base. em química
Foram encontradas 77 questões
Considere uma amostra aquosa em equilíbrio a 60 °C, com pH de 6,5, a respeito da qual são feitas as seguintes afirmações:
I. A amostra pode ser composta de água pura.
II. A concentração molar de H3O+ é igual à concentração de OH − .
III. O pH da amostra não varia com a temperatura.
IV. A constante de ionização da amostra depende da temperatura.
V. A amostra pode ser uma solução aquosa 0,1mol.L−1em H2 CO3, considerando que a constante de dissociação do H2 CO3 é da ordem de 1 x 10−7 .
Das afirmações acima está(ão) CORRETA(S) apenas
Espera-se que uma fração menor das moléculas de H2SO4 sofra a segunda ionização após o tratamento da água contaminada do lago com um composto químico básico.
O óxido de cálcio (CaO) é um óxido ácido.
A composição química do cimento Portland, utilizado na construção civil, varia ligeiramente conforme o que está indicado na tabela abaixo:
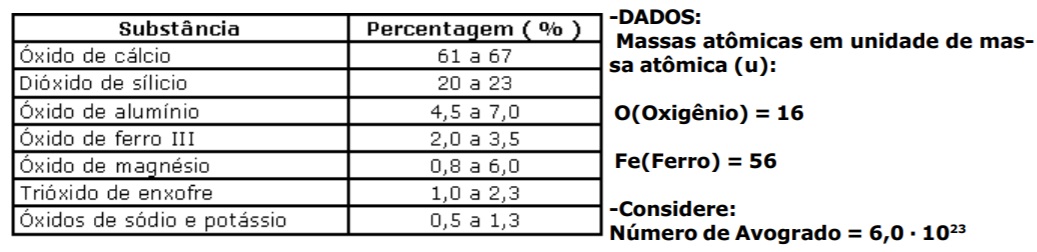
Assinale a alternativa correta:
A concentração em mol · L-1 dos íons sulfato ( SO
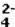 ) presentes na solução final é :
) presentes na solução final é :
A água pura, o ácido clorídrico puro (HCl) e o ácido acético puro (CH3COOH) são maus condutores de corrente elétrica. Porém, esses ácidos em solução aquosa são condutores de eletricidade.
Uma solução aquosa diluída de HCl conduz a
corrente elétrica melhor que a de ácido acético
em solução porque:
Solução do frasco I: ficou rosa em fenolftaleína e amarela no metilorange.
Solução do frasco II: permaneceu incolor em fenolftaleína e vermelha no metilorange.
Solução do frasco III: permaneceu incolor em fenolftaleína e amarela no metilorange.
Sabe-se que a fenolftaleína, em pH acima de 9 apresenta coloração vermelha, enquanto que, em pH abaixo desse valor, é incolor. Sabe-se ainda que o metilorange apresenta coloração vermelha em pH abaixo de 3,5 e amarela em pH acima deste valor.
Sendo assim, os estudantes chegaram à conclusão de que os frascos I, II e III contêm, respectivamente, solução de
A 25 °C, três frascos (I, II e III) contêm, respectivamente, soluções aquosas 0,10 mol L−1 em acetato de sódio, em cloreto de sódio e em nitrito de sódio.
Assinale a opção que apresenta a ordem crescente CORRETA de valores de pHx (x = I,II e III) dessas soluções, sabendo que as constantes de dissociação (K) , a 25 °C, dos ácidos clorídrico (HCl) , nitroso (HNO2) e acético (CH3COOH) , apresentam a seguinte relação:
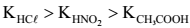
( ) Espécies químicas que têm na sua composição hidrogênio com carga parcial positiva, Hδ+, são ácidos de Arrhenius.
( ) Bases de Brönsted-Lowry têm na sua composição átomos com pares de elétrons não-ligantes.
( ) Bases de Brönsted-Lowry, em água, produzem íons OH-.
( ) Ácidos de Arrhenius são substâncias iônicas.
pós a dissolução, as soluções contidas nas provetas 1 e 2 apresentam, respectivamente, caráter