Questões Militares
Sobre substâncias inorgânicas: dissociação iônica e ionização, conceitos de ácido-base. em química
Foram encontradas 77 questões
Conversores catalíticos (catalisadores) de automóveis são utilizados para reduzir a emissão de poluentes tóxicos. Poluentes de elevada toxicidade são convertidos a compostos menos tóxicos. Nesses conversores, os gases resultantes da combustão no motor e o ar passam por substâncias catalisadoras. Essas substâncias aceleram, por exemplo, a conversão de monóxido de carbono (CO) em dióxido de carbono (CO2) e a decomposição de óxidos de nitrogênio como o NO, N2O e o NO2 (denominados NOx) em gás nitrogênio (N2) e gás oxigênio (O2). Referente às substâncias citadas no texto e às características de catalisadores, são feitas as seguintes afirmativas:
I - a decomposição catalítica de óxidos de nitrogênio produzindo o gás oxigênio e o gás nitrogênio é classificada como uma reação de oxidorredução;
II - o CO2 é um óxido ácido que, ao reagir com água, forma o ácido carbônico;
III - catalisadores são substâncias que iniciam as reações químicas que seriam impossíveis sem eles, aumentando a velocidade e também a energia de ativação da reação;
IV - o CO é um óxido básico que, ao reagir com água, forma uma base;
V - a molécula do gás carbônico (CO2) apresenta geometria espacial angular.
Das afirmativas feitas estão corretas apenas a
Analise as afirmativas a seguir.
I. Ácido é toda substância que doa prótons.
II. Ácido é toda substância que recebe elétrons.
III. Ácido é toda substância que se ioniza em presença de água e origina, como um dos íons, o cátion H+ .
IV. Base é toda substância que recebe elétrons.
V. Base é toda substância que, em solução aquosa, sofre dissociação iônica, liberando o ânion OH– .
VI. Base é toda substância capaz de receber prótons.
Tratam da teoria de Bronsted-Lowry apenas as afirmativas
CONSTANTES

DEFINIÇÕES


Considere as seguintes proposições para espécies químicas no estado gasoso:
I. A energia de ionização do íon Be3+ é maior do que a do íon He+ .
II. O momento dipolar elétrico total da molécula de XeF4 é maior do que o da molécula de XeF2.
III. A energia necessária para quebrar a molécula de F2 é maior do que a energia necessária para quebrar a molécula de O2.
IV. A energia do orbital 2s do átomo de berílio é igual à energia do orbital 2s do átomo de boro.
Das proposições acima, está(ão) CORRETA(S)
CONSTANTES

DEFINIÇÕES


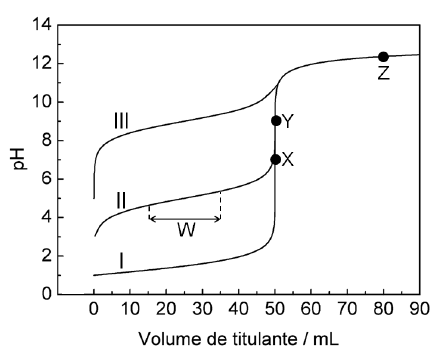
Na figura ao lado são respectivamente apresentadas as curvas de titulação de 50 mL de soluções aquosas 0,1 mol·L-1 dos ácidos I, II e III, tituladas com uma solução aquosa 0,1 mol·L-1 em NaOH. Baseado nas informações contidas na figura, assinale opção ERRADA.
Uma solução aquosa de cloreto ferroso foi preparada pela dissolução de 25,4 gramas desse soluto em água suficiente para 500 mL de solução.
Admitindo-se que o grau de dissociação desse sal nesta solução é de 40%, a concentração de íons cloreto, em mol/L de solução, é igual a
De acordo com o conceito de ácido-base de BronstedLowry, analise as equações abaixo.
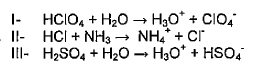
Com base nas equações acima, é INCORRETO afirmar
que
O rótulo de uma garrafa de água mineral apresenta a seguinte descrição:
COMPOSIÇÃO QUÍMICA PROVÁVEL (mg/L): bicarbonato de bário = 0,38; bicarbonato de estrôncio = 0,03; bicarbonato de cálcio = 66,33; bicarbonato de magnésio = 50,18; bicarbonato de potássio = 2,05; bicarbonato de sódio = 3,04; nitrato de sódio = 0,82; cloreto de sódio = 0,35.
CARACTERÍSTICAS FÍSICO-QUÍMICAS: pH medido a 25 °C = 7,8; temperatura da água na fonte = 18 °C; condutividade elétrica a 25 °C = 1,45·10-4 mhos/cm; resíduo de evaporação a 180 °C = 85,00 mg/L; radioatividade na fonte a 20 °C e 760 mm Hg = 15,64 maches.
A respeito da água mineral citada, de sua composição e características, são feitas as seguintes afirmativas:
I – esta água apresenta caráter básico nas condições citadas.
II – a água mineral citada pode ser classificada como uma solução, em razão da presença de substâncias dissolvidas.
III – todas as substâncias químicas presentes na composição provável apresentada são da função inorgânica Sal.
A1203 + 6HC1 → 2Al3 + 6C1- + 3H20
A12O3 + 20H- + 3H20 → 2 [Al (OH)4]-
Pode-se afirmar que o A12O3 é um óxido

Com base nestes dados, e sabendo que HA tem constante de ionização igual a 4,0 x 10−10, é coerente afirmar que o indicador HA
(Dado: log 4 = 0,6)
I. H2PO4 (aq) + H2O(ℓ) → HPO4 2 (aq) + H3O (aq) II. HPO4 2 (aq) + H2O(ℓ) → H2PO4 (aq) + OH (aq) III. [Aℓ(H2O)6]3 (aq) + H2O(ℓ) → [Aℓ(H2O)5OH]2 (aq) + H3O (aq) IV. CaO(s) + H2O(ℓ) → Ca2 (aq) + 2 OH (aq)
São dadas as energias de ligação H - X, para X = F, Cℓ, Br, I
HF(g) 567 kJ/mol
HCℓ(g) 431 kJ/mol
HBr(g) 366 kJ/mol
HI(g) 299 kJ/mol
I - H2Cr20,
II - Cr03
III- NH4OH
IV - BaO
V - NaHS03
VI - ZnO
Acerca dessas fórmulas é correto afirmar que, quando dissolvidas pequenas quantidades em água destilada, as substâncias: