Questões Militares
Comentadas sobre teoria atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica em química
Foram encontradas 49 questões
A pólvora é material empregado como propulsor em armas de fogo. Basicamente, a ideia é provocar uma reação que gere uma quantidade grande de gases sob pressão e temperatura elevadas. Ao se expandirem, esses gases impulsionam um projétil. A pólvora negra, empregada em armas mais antigas, é constituída por uma mistura de salitre (KNO3), enxofre (S) e material de carbono (C). A equação não balanceada de uma das reações químicas que ocorrem durante a queima da pólvora é apresentada a seguir.
KNO3 (s) + S (s) + C (s) → K2S (s) + N2 (g) + CO2 (g)
Considerando essas informações e sabendo que o número atômico do carbono é igual a 6, julgue o item que se segue.
Um átomo neutro do isótopo de carbono-12, no estado fundamental, apresenta, em seu núcleo, 6 prótons e 6 nêutrons; além disso, apresenta 6 elétrons na região extranuclear.
A pólvora é material empregado como propulsor em armas de fogo. Basicamente, a ideia é provocar uma reação que gere uma quantidade grande de gases sob pressão e temperatura elevadas. Ao se expandirem, esses gases impulsionam um projétil. A pólvora negra, empregada em armas mais antigas, é constituída por uma mistura de salitre (KNO3), enxofre (S) e material de carbono (C). A equação não balanceada de uma das reações químicas que ocorrem durante a queima da pólvora é apresentada a seguir.
KNO3 (s) + S (s) + C (s) → K2S (s) + N2 (g) + CO2 (g)
Considerando essas informações e sabendo que o número atômico do carbono é igual a 6, julgue o item que se segue.
Entre os produtos da reação química apresentada, podem ser
identificadas uma substância iônica e duas substâncias
moleculares; entre as substâncias moleculares, uma é polar e,
a outra, apolar.
A respeito da matéria e de sua constituição química, julgue o item a seguir.
Elemento químico pode ser considerado um conceito teórico,
por ser definido como tipo de átomos, também definido por
um número atômico.
Quando um átomo, ou um grupo de átomos, perde a neutralidade elétrica, passa a ser denominado de íon. Sendo assim, o íon é formado quando o átomo (ou grupo de átomos) ganha ou perde elétrons. Logicamente, esse fato interfere na distribuição eletrônica da espécie química. Todavia, várias espécies químicas podem possuir a mesma distribuição eletrônica.
Considere as espécies químicas listadas na tabela a seguir:

A distribuição eletrônica 1s2, 2s2, 2p6, 3s2, 3p6 (segundo o Diagrama de Linus Pauling) pode
corresponder, apenas, à distribuição eletrônica das espécies
Embora o peróxido de hidrogênio (H2O2) não seja considerado um radical livre, ele é responsável, direta ou indiretamente, por diversas patologias. Em termos químicos, esse óxido é fracamente reativo, porém exerce papel deletério no organismo, por ser capaz de transpor facilmente membranas celulares e gerar o radical hidroxil (•OH), seja por meio de exposição à luz ultravioleta (equação I), seja por interação com metais de transição, como o ferro, por meio do processo conhecido como reação de fenton (equação II).

Considerando as informações acima, julgue o item a seguir.
A configuração eletrônica do íon Fe3+, segundo o diagrama de Linus
Pauling, é 1s2
2s2
2p6
3s2
3p6
4s2
3d3
.
Os elementos A, B e C têm as seguintes configurações eletrônicas em suas camadas de valência:
A — 3S1
B — 4s2 4p4
C — 3s2
Com base nessas informações, assinale a opção correta.
Moléculas de lítio não existem no estado líquido ou sólido, mas, sem dúvida, as moléculas diatômicas são encontradas no lítio gasoso. A energia de ligação do Li2 é 105 kJ/mol.
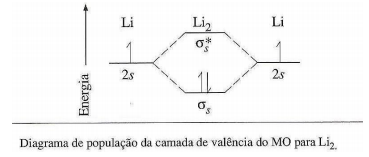
Sobre o diagrama de população da camada de valência do MO para Li2, analise as afirmativas a seguir.
I. A ordem de ligação é 1/2.
II. A configuração eletrônica de Li2 pode ser escrita como KK (σs)2 .
III. A energia de ligação do Li2 é menor do que H2 porque há uma blindagem do núcleo pela camada K completa de cada átomo.
Está(ão) correta(s) apenas a(s) afirmativa(s)
CONSTANTES

DEFINIÇÕES


Munições traçantes são aquelas que possuem um projétil especial, contendo uma carga pirotécnica em sua retaguarda. Essa carga pirotécnica, após o tiro, é ignificada, gerando um traço de luz colorido, permitindo a visualização de tiros noturnos a olho nu. Essa carga pirotécnica é uma mistura química que pode possuir, dentre vários ingredientes, sais cujos íons emitem radiação de cor característica associada ao traço luminoso.
Um tipo de munição traçante usada por um exército possui na sua composição química uma determinada substância, cuja espécie química ocasiona um traço de cor correspondente bastante característico.
Com relação à espécie química componente da munição desse exército sabe-se:
I) A representação do elemento químico do átomo da espécie responsável pela coloração pertence à família dos metais alcalinos-terrosos da tabela periódica.
II) O átomo da espécie responsável pela coloração do traço possui massa de 137 u e número de nêutrons 81.
Sabe-se também que uma das espécies apresentadas na tabela do item III (que mostra a relação de cor emitida característica conforme a espécie química e sua distribuição eletrônica) é a responsável pela cor do traço da munição desse exército.
III) Tabela com espécies químicas, suas distribuições eletrônicas e colorações características:

Considerando os dados contidos, nos itens I e II, atrelados às informações da tabela do
item III, a munição traçante, descrita acima, empregada por esse exército possui traço de coloração
O estudo da Lei Periódica permite que sejam
estudadas as principais propriedades periódicas
dos elementos químicos.
Dados: A= massa atômica; d= densidade em
g∙cm-3
Considerando a capacidade de predição da
Tabela Periódica e dado o trecho dela, afirma-se
corretamente que a massa atômica e a
densidade mais prováveis do alumínio são,
respectivamente:
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
considere as espécies de (I) a (IV) e o arcabouço da Tabela Periódica representados a seguir. Assinale a alternativa correta.
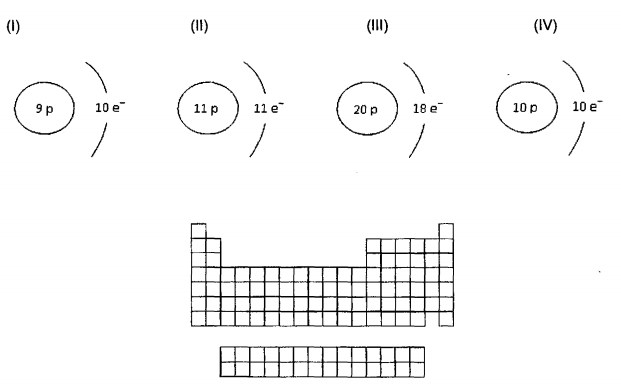
I. Com relação à afinidade eletrônica, a ordem correta é P > Se > Na > Cu.
II. Um metal alcalino terroso do terceiro período apresenta menor raio atômico do que um metal do quinto período e do mesmo grupo.
III. A primeira energia de ionização dos elementos decresce de cima para baixo num grupo ou família.
Está(ão) correta(s) a(s) afirmativa(s)