Questões Militares
Sobre transformações químicas em química
Foram encontradas 475 questões
Uma solução aquosa de cianeto de sódio foi adicionada a uma solução aquosa de permanganato de potássio, em meio básico. Assim, foram formados o óxido de manganês (IV) sólido e o íon cianato, CNO– .
Na semirreação envolvendo um mol do íon cianeto há a participação de ________ elétrons.
No balanceamento da equação global da reação envolvendo 2 mol do íon permanganato, participam _______ de íons hidroxila representados no lado dos _______ da equação de reação.
Assinale a alternativa que preenche, correta e respectivamente, as lacunas do texto.
Dois cilindros mantidos sob a mesma temperatura contêm gases puros, sendo ozônio no cilindro 1 e dióxido de enxofre no cilindro 2. A capacidade volumétrica do cilindro 2 é igual à metade da capacidade volumétrica do cilindro 1. Os dois gases estão sob a mesma pressão.
A relação entre a massa de gás do cilindro 1 e a massa de gás do cilindro 2 é igual a:
São apresentadas as configurações eletrônicas no estado fundamental de três elementos químicos:
I. [Ne] 3s2 3p1
II. [Ar]3s2
III. [Ne]3s2 3p5
A respeito desses elementos químicos, é correto afirmar que, dentre eles,
Uma das pesquisas realizadas no século 19, que foi de grande importância para o desenvolvimento dos modelos atômicos, empregava um dispositivo conhecido como ampola ou tubo de Crookes.
Com esse tipo de dispositivo, foram estudados os raios catódicos, que eram de fato ----------- que se direcionavam para o polo ----------- do tubo.
As lacunas são preenchidas, correta e respectivamente, por
2NH3 + CO2 ➝ NH2C(O)ONH4
NH2C(O)ONH4 ➝ (NH2)2CO + H2O
As etapas são, respectivamente, classificadas como reações de


A diferença entre os diâmetros foi explicada pela presença de prótons e nêutrons no núcleo muito denso e pela disposição de elétrons em camadas na eletrosfera, num modelo atômico planetário.
A esse respeito, analise as afirmativas a seguir.
I. O raio atômico do estrôncio é igual ao raio atômico da prata, pois ambos átomos possuem o mesmo número de camadas eletrônicas.
II. O raio atômico do cálcio é maior do que o raio atômico do bário, pois o cálcio apresenta maior número de camadas eletrônicas.
III. O raio atômico do potássio é maior do que o raio atômico do zinco, pois o potássio tem menor carga nuclear.
Está correto o que se afirma em


Considere os átomos sódio (Na), potássio (K), ferro (Fe), césio (Cs) e iodo (I).
Nesse conjunto, o átomo que necessita de radiação eletromagnética de menor frequência para a emissão de fotoelétrons é


Sobre os átomos 6C12, 6C13 e 6C14, é correto afirmar que eles possuem


A configuração eletrônica do escândio, no estado fundamental, é:
As ideias sobre os átomos e sua composição passaram por diversas modificações ao longo dos anos. A partir de estudos, foram propostos alguns modelos que explicariam de que seria formada a menor parte que constitui a matéria. Analise a seguir os modelos propostos e seus respectivos cientistas responsáveis:
I. O átomo é uma esfera maciça, indestrutível e que pode ser dividido - Dalton
II. O átomo é uma esfera maciça de carga positiva encrustada de elétrons - Thomson
III. O átomo possui um núcleo positivo, com elétrons girando ao seu redor – Rutherford
A correlação entre o cientista e suas ideias está correta
O gás nitrogênio (N2) é o que se encontra em maior proporção no ar atmosférico. Por ser considerado um gás inerte, ele pode estar presente em diversos processos laboratoriais e industriais. Sua obtenção é feita através da liquefação fracionada do ar atmosférico. Supondo que, a partir desse processo, obteve-se uma amostra de 280g desse gás, é correto afirmar que o volume ocupado por ele sob condições normais de temperatura e pressão foi de
Dado: MMN = 14 g/mol
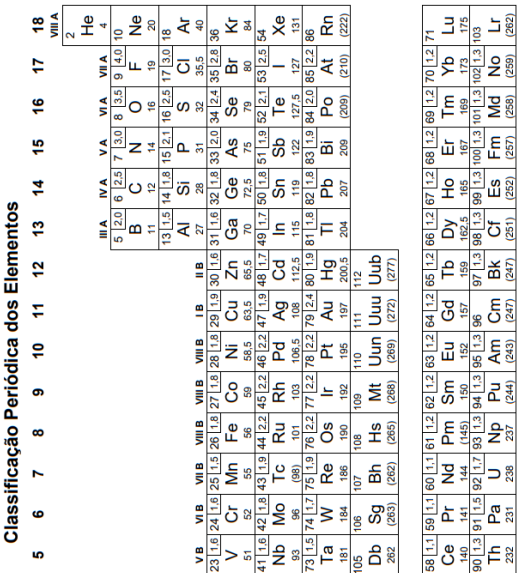
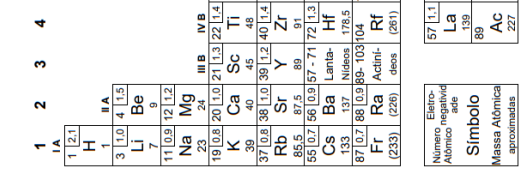
Considere os elementos:
ósmio – iodo – bário – chumbo
Com base nas posições desses elementos na Classificação Periódica, o elemento de maior densidade e o de menor eletronegatividade são, respectivamente,
A tabela mostra a distribuição eletrônica, em níveis de energia, do átomo do gás nobre argônio, Ar.
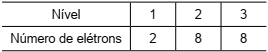
Dois dos íons que apresentam essa mesma distribuição eletrônica são:
