Questões Militares
Sobre transformações químicas em química
Foram encontradas 475 questões
( ) Os elementos do Grupo 1A, os metais alcalinos, sofrem reações similares com água e formam compostos do tipo MOH (M= Li, Na, K).
( ) Os elementos do Grupo 2A, os metais alcalinos terrosos, sofrem reações com a água e formam compostos do tipo MOH(M= Mg, Ca, Sr, Ba).
( ) Os elementos do Grupo 7A, os halogênios, sofrem reações similares com metais e outros não metais.
( ) Considerando a família 4A, apenas C e Si reagem com outros elementos para formar compostos semicondutores.
Assinale a sequência correta.
: I- Pb(NO3)2 + K2CrO4 → PbCrO4 + 2 KNO3
II- FeCl3 + 3 NaOH → Fe(OH)3 + 3 NaCl
III- BaNO3 + NaOH → Ba(OH)2 + NaNO3
IV- 2 AgNO3 + K2CrO4 → Ag2CrO4 + 2 KNO3
V- MgCl2 + 2 NaOH → Mg(OH)2 + 2 NaCl
Considerando os produtos de cada reação, somente não formará precipitado na reação:


Experimentos foram realizados, bombardeando cada material com uma quantidade de partículas a e registrando o número de partículas coletadas em cada detector, conforme a tabela abaixo.
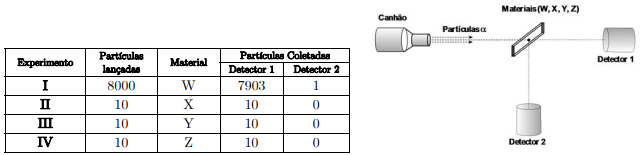
A partir dessas informações, assinale a alternativa que apresenta a conclusão CORRETA sobre as observações feitas nos experimentos.
Acidentes com gases tóxicos se tornam cada vez mais frequentes no Brasil. Segundo especialistas militares do Corpo de Bombeiros, o gás tóxico presente em unidades frigoríficas, indústrias de pescados e laticínios e em unidades de refrigeração industrial é o responsável por grande parte dos acidentes.
Esse gás apresenta um odor característico forte, quimicamente sua molécula é polar, e a sua estrutura contém quatro nuvens eletrônicas ao redor do átomo central, por meio da qual esse átomo apresenta um par de elétrons não ligante.
De acordo com as características da estrutura química desse composto gasoso, qual é a sua fórmula molecular?
Leia o texto a seguir e resolva a questão:
“Soldados recebem palestra sobre ansiedade e depressão
Cascavel (PR) – O 15º Batalhão Logístico promoveu, no dia 11 de março, uma palestra com o tema “Ansiedade e Depressão na Juventude”. A atividade foi voltada para os jovens soldados recém-incorporados às fileiras do Exército. Colaborou com a atividade o Dr. Marco Antônio da Silva Cristovam, professor e médico pediatra com área de atuação em Medicina do Adolescente. A atividade faz parte do Programa de Valorização da Vida.”
Fonte: https://www.eb.mil.br/web/noticias/noticiario-do-exercito. Acessado em 16 MAR 21.
Atualmente, medicamentos à base de sais de lítio (Li) vêm sendo empregados para o tratamento de casos de depressão em pacientes maníaco-depressivos. A respeito do elemento químico lítio e de suas espécies químicas, avalie as seguintes afirmativas:
I) Um átomo neutro de lítio com número de massa 7 possui 3 prótons, 3 elétrons e 4 nêutrons.
II) O íon Li1+ possui distribuição eletrônica semelhante à de um átomo neutro de berílio.
III) O átomo de lítio é o que possui o menor raio atômico dentre os metais alcalinos.
IV) O estabelecimento da ligação química entre um átomo de lítio e um átomo de cloro, no sal cloreto de lítio, dá-se por meio de uma ligação iônica.
V) O elemento químico lítio está localizado no grupo 2 e no período 1 da Tabela Periódica.
Das afirmativas feitas, estão corretas apenas
Qual a massa de nitrogênio, em kg?
Na reação de dupla troca do (NH4)2SO4 com o CaCl2, um dos compostos gerados é o sulfato de cálcio, de fórmula CaSO4.
Com relação às características eletrônicas do arsênico (número atômico 33), assinale (V) para a afirmativa verdadeira e (F) para a falsa. ( ) Possui elétrons distribuídos em três níveis eletrônicos. ( ) Seu elétron de maior energia ocupa o nível P. ( ) Possui cinco elétrons na camada de valência.
As afirmativas são, segundo a ordem apresentada, respectivamente,
Uma pesquisa recente propõe a identificação de resíduos de armas de fogo por meio de marcadores luminescentes, formados por compostos de lantanídeos. Esses compostos, adicionados à parte interna da munição, espalham-se no chão, mãos e roupas, após o disparo de uma arma, podendo ser detectados com luz negra. Quatro cores podem ser aplicadas ao procedimento:

Sabe-se que a cor de um átomo resulta das transições de seus elétrons entre os subníveis de energia. A cor do lantanídeo cujos átomos apresentam nove elétrons em seu subnível de maior energia no estado fundamental é:
Com os uniformes cobertos de barro, os militares bombeiros estavam por todos os lados no mar de lama e detritos que arrasou a cidade de Brumadinho devido ao acidente da barragem ocorrido no ano de 2019. A lama de rejeito provocou um rastro de destruição ao longo do Rio Paraopeba. Segundo especialistas, em toda a extensão percorrida, a água do rio não tinha condições para o consumo humano e animal. Dentre vários contaminantes, encontraram-se metais em altas concentrações como ferro, cobre, manganês e cromo.
Sobre os metais citados no texto, aquele que, quando o átomo se encontra ionizado no estado de oxidação +2 apresentará a configuração eletrônica 1s2 2s2 2p6 3s2 3p6 3d5 é o:
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

(1) A intensidade da luz depende da frequência ou do comprimento de onda da radiação empregada. (2) Dentre as cores do espectro visível, a azul é a que possui maior intensidade devido ao seu menor comprimento de onda. (3) Dentro do espectro visível, a luz vermelha é a radiação que possui o menor comprimento de onda. (4) O estado do elétron em um átomo é completamente definido pelos números quânticos n, l, ml . (5) A configuração eletrônica dos átomos é determinada pelo princípio da construção, pelo princípio da exclusão de Pauli e pela regra de Hund. (6) Na tabela periódica, os pares de elementos com relação diagonal geralmente exibem propriedades químicas semelhantes.
A soma dos números associados às sentenças ERRADAS é igual a
Considere os dados apresentados na tabela.
Regiões da atmosfera Densidade do ar kg.m–3 Temperatura °C Pressão atm
troposfera 1 17 1
mesosfera 7 x 10–6 –83 X
(Bottecchia, O.L. Química Nova. Adaptado)
Considerando que a massa molar do ar em toda a atmosfera é aproximadamente constante, 29 g.mol–1, o valor
da pressão atmosférica na mesosfera, X, na temperatura
indicada na tabela é aproximadamente
Esse experimento refere-se ______ e à emissão de ______ .
Assinale a alternativa que completa, correta e respectivamente, as lacunas.

Os coeficientes que correspondem às letras x, y e z são, respectivamente:
I- X pertence ao grupo dos metais alcalinos;
II- Y pertence ao grupo dos metais alcalinos terrosos;
III- Z pertence ao grupo dos gases nobres;
IV- X, Y e Z não pertencem ao mesmo período da tabela periódica.
Marque a opção correta.