Questões Militares
Sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 77 questões
2NO(g) + O2(g) →2NO2(g) , v = k[NO]2 [O2]
Para esta reação, são propostos os mecanismos reacionais I, II e III com suas etapas elementares de reação:
I. 2NO(g) ⇌ N2O2 (g) equilíbrio rápido
N2O2(g) + O2(g) → 2NO2 (g) lenta
II. NO(g) + O2 (g) ⇌ NO3(g) equilíbrio rápido
NO (g) + NO3 (g) → 2NO2 (g) lenta
III. NO(g) + ½ O2(g) → NO2(g) rápida
NO2(g) + ½ O2(g) ⇌ NO3(g) equilíbrio rápido
NO2(g) + NO3(g) ⇌ N2O4(g) equilíbrio rápido
N2O4(g) → 2NO2 (g) lenta
Dos mecanismos propostos, são consistentes com a lei de velocidade observada experimentalmente
I. Para reações bimoleculares, o fator pré-exponencial na equação de Arrhenius é proporcional à frequência de colisões, efetivas ou não, entre as moléculas dos reagentes.
II. O fator exponencial na equação de Arrhenius é proporcional ao número de moléculas cuja energia cinética relativa é maior ou igual à energia de ativação da reação.
III. Multiplicando-se o negativo da constante dos gases (−R) pelo coeficiente angular da reta ln k versus 1/T obtém-se o valor da energia de ativação da reação.
IV. O fator pré-exponencial da equação de Arrhenius é determinado pela intersecção da reta ln k versus 1/T com o eixo das abscissas.
Das proposições acima, está(ão) ERRADA(S)
Observe a reação a seguir.
NO2(g) + O3(g) → NO3(g) O2(g)
Dados a 25 °C :
Lei da velocidade: velocidade = k[NO2][O3]
Constante de velocidade (k) : k = 4,4 x 107 dm3 • mol-1 • s-1
[NO2] : concentração de dióxido de nitrogênio (NO2)
[O3] : concentração de ozônio (O3)
A reação química acima ocorre na atmosfera terrestre quando o dióxido de nitrogênio presente no ar poluído entra em contato
com o ozônio. Com relação a este fenômeno químico, é
correto afirmar que:
I. X(g)+e–→ X (g)+E1 II. X (g)+E2→X(g)+e- III. X(g)+E3→ X+(g)+e- IV. X+ (g)+E4→X2+ (g)+e-
Com base nas equações representadas, pode-se afirmar que:
I. Se o gráfico de [X] em função do tempo for uma curva linear, a lei de velocidade da reação dependerá somente da constante de velocidade.
II. Se o gráfico de 1/[X] em função do tempo for uma curva linear, a ordem de reação será 2.
III. Se o gráfico da velocidade da reação em função de [X] for uma curva linear, a ordem de reação será 1.
IV. Se o gráfico da velocidade de reação em função de [X]2 for uma curva linear, a ordem de reação será 2.
Das proposições acima, está(ão) CORRETA(S)
A reação de hidrólise da acetilcolina, esquematizada abaixo, é fundamental na transmissão de impulsos nervosos nos seres vivos. A reação é promovida pela enzima acetilcolinesterase (AChE).
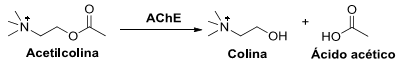
Considere as seguintes afirmativas sobre o papel de AChE nessa reação:
1. AChE é catalisador da reação.
2. AChE aumenta a energia de ativação da reação.
3. AChE promove caminhos reacionais alternativos.
4. AChE inibe a formação de intermediários.
Assinale a alternativa correta.
O texto a seguir serve como base para a resolução da questão.
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a
Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro
preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro
(Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2 (g) COCl2 (g).
O texto a seguir serve como base para a resolução da questão.
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro (Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2(g) → COCl2 (g).
Em um reator foram dispostos 560 g de monóxido de carbono e 355 g de cloro. Admitindo-se a reação entre o monóxido de carbono e o cloro com rendimento de 100 % da reação e as limitações de reagentes, a massa de fosgênio produzida é de
Dados:
- massas atômicas: C = 12 u ; Cl = 35,5 u; O = 16 u
Sobre o incidente do meteoro russo, assinale a alternativa correta:
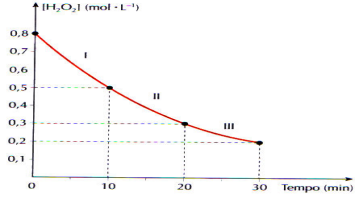 Calcule a velocidade média de decomposição da água
oxigenada, em mol.L-1.min-1, nos intervalos I, II, I e no
intervalo de 0 a 30 min:
Calcule a velocidade média de decomposição da água
oxigenada, em mol.L-1.min-1, nos intervalos I, II, I e no
intervalo de 0 a 30 min: Considere a reação catalisada descrita pelo mecanismo a seguir.
Primeira etapa: A + BC → AC + B
Segunda etapa: AC + D → A + CD
O perfil energético dessa reação segue a representação do gráfico abaixo.
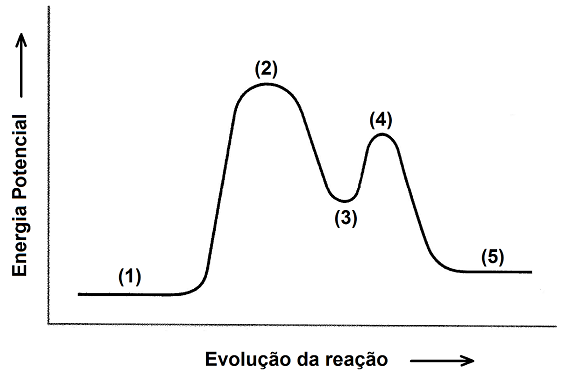
Diante das informações apresentas, é correto afirmar que
Considere a reação química genérica A → B + C . A concentração do reagente [A] foi acompanhada ao longo do tempo, conforme apresentada na tabela que também registra os logaritmos neperianos (ℓn) desses valores e os respectivos recíprocos (1/[A]).
t (s) [A] (mol ∙ L−1) ℓn [A] 1/[A] (L ∙ mol−1)0 0,90 − 0,11 1,11
100 0,63 − 0,46 1,59
200 0,43 − 0,84 2,33
300 0,30 − 1,20 3,33
400 0,21 − 1,56 4,76
500 0,14 − 1,97 7,14
600 0,10 − 2,30 10,00
Assinale a opção que contém a constante de velocidade CORRETA desta reação.
A + B
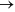 D
D Para tanto dispõe-se dos dados abaixo obtidos empiricamente em diferentes condições de concentrações iniciais:

Assinale a opção que apresenta o valor e a unidade da constante de velocidade a 500°C.
(---) Se a concentração molar de N2O5 for duplicada, a velocidade da reação será reduzida à metade.
(---) Se a concentração molar de N2O5 for triplicada, a velocidade da reação também triplicará.
(---) Se a concentração molar de N2O5 for reduzida à metade, a velocidade da reação duplicará.
O gráfico abaixo ilustra as variações de energia devido a uma reação química conduzida nas mesmas condições iniciais de temperatura, pressão, volume de reator e quantidades de reagentes em dois sistemas diferentes. Estes sistemas diferem apenas pela presença de catalisador. Com base no gráfico, é possível afirmar que:
A água oxigenada ou solução aquosa de peróxido de hidrogênio ( H2O2) é uma espécie bastante utilizada no dia a dia na desinfecção de lentes de contato e ferimentos. A sua decomposição produz oxigênio gasoso e pode ser acelerada por alguns fatores como o incremento da temperatura e a adição de catalisadores. Um estudo experimental da cinética da reação de decomposição da água oxigenada foi realizado alterando-se fatores como a temperatura e o emprego de catalisadores, seguindo as condições experimentais listadas na tabela a seguir:

O etino, também conhecido como acetileno, é um alcino muito importante na Química. Esse composto possui várias aplicações, dentre elas o uso como gás de maçarico oxiacetilênico, cuja chama azul atinge temperaturas em torno de 3000 °C.
A produção industrial do gás etino está representada, abaixo, em três etapas, conforme as equações balanceadas:

Considerando as etapas citadas e admitindo que o rendimento de cada etapa da obtenção do
gás etino por esse método é de 100 %, então a massa de carbonato de cálcio (CaCO3(s)) necessária para produzir 5,2 g do gás etino (C2H2(g)) é