Questões Militares
Sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 75 questões
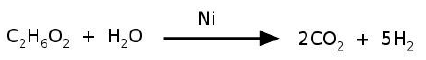
Nas condições mencionadas, a reação de reforma ocorre num tempo menor quando usado o níquel poroso porque:
αA + βΒ + χC D + E
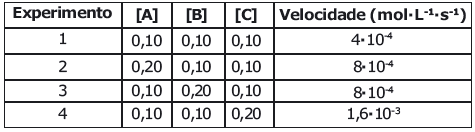
A partir dos resultados experimentais apresentados na tabela, pode se afirmar que a expressão da equação da lei da velocidade (V) para essa reação química é
analise a reação abaixo, com a sua respectiva equação de velocidade:
NO2(g) + CO(g) → NO(g) + CO2(g) v = kr [NO2]2
Os valores da ordem da reação acima em relação ao NO2,
ao CO, e à Ordem Global são, respectiva mente:
A reação em fase gasosa a A + b B → c C + d D foi estudada em diferentes condições de concentração inicial dos reagentes, tendo sido obtidos os seguintes resultados experimentais, todos na mesma temperatura:
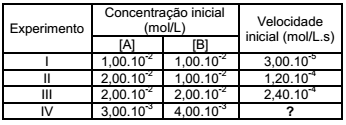
A partir dos dados experimentais da tabela, indique a
alternativa que apresenta o valor correto da velocidade
inicial da reação no experimento IV.
Conversores catalíticos (catalisadores) de automóveis são utilizados para reduzir a emissão de poluentes tóxicos. Poluentes de elevada toxicidade são convertidos a compostos menos tóxicos. Nesses conversores, os gases resultantes da combustão no motor e o ar passam por substâncias catalisadoras. Essas substâncias aceleram, por exemplo, a conversão de monóxido de carbono (CO) em dióxido de carbono (CO2) e a decomposição de óxidos de nitrogênio como o NO, N2O e o NO2 (denominados NOx) em gás nitrogênio (N2) e gás oxigênio (O2). Referente às substâncias citadas no texto e às características de catalisadores, são feitas as seguintes afirmativas:
I - a decomposição catalítica de óxidos de nitrogênio produzindo o gás oxigênio e o gás nitrogênio é classificada como uma reação de oxidorredução;
II - o CO2 é um óxido ácido que, ao reagir com água, forma o ácido carbônico;
III - catalisadores são substâncias que iniciam as reações químicas que seriam impossíveis sem eles, aumentando a velocidade e também a energia de ativação da reação;
IV - o CO é um óxido básico que, ao reagir com água, forma uma base;
V - a molécula do gás carbônico (CO2) apresenta geometria espacial angular.
Das afirmativas feitas estão corretas apenas a
Para que uma reação ocorra, é necessário que os reagentes recebam certa quantidade de energia, a chamada energia de ativação. As moléculas reagentes formarão o complexo ativado se tiverem energia suficiente e se colidirem de um modo geometricamente favorável para a formação do complexo.
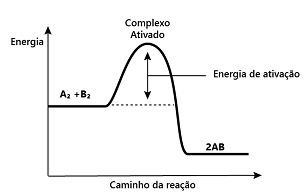
A respeito do complexo ativado, pode-se afirmar que
CONSTANTES

DEFINIÇÕES


CONSTANTES

DEFINIÇÕES


Sob determinadas condições, a velocidade de formação do dióxido de silício (SiO2) na reação é de 2,4 mmol[/dm3.s:
Al2O3(s)+ Si(s)-> SiO2(s)+ Al(s)
Então, qual a velocidade de consumo de Al2O3(s)?
“A Olimpíada deve ser disputada sem o fantasma da fraude química, dentro do princípio de que, tanto quanto é importante competir, vencer é prova de competência”. (Jornal “O Globo”, 28/05/2016)
Considere que um atleta tenha consumido 64 mg de um anabolizante e que, após 4 dias, o exame antidoping tenha detectado apenas 0,25 mg deste composto. Assumindo que a degradação do anabolizante no organismo segue uma cinética de 1ª ordem, assinale a alternativa que apresenta o tempo de meia-vida da substância no organismo do atleta.
Analise a tabela a seguir, e assinale a opção que completa corretamente as lacunas da sentença abaixo.
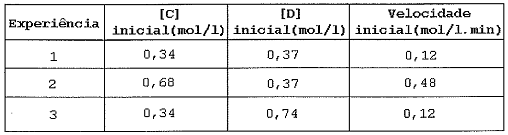
Dada a reação: C + 2D → produtos, foram efetuadas 3 experiências e montada a tabela acima.
Analisando as experiências, é correto afirmar que a velocidade de reação é de ___________ em relação a _________ .
Conversores catalíticos de automóveis são utilizados para reduzir a emissão de poluentes. Os gases resultantes da combustão no motor e o ar passam por substâncias catalisadoras que aceleram a transformação de monóxido de carbono (CO) em dióxido de carbono (CO2) e a decomposição de óxidos de nitrogênio (genericamente NxOy) em gás nitrogênio (N2) e gás oxigênio (O2). Em relação ao uso de catalisadores e as substâncias citadas no texto, são feitas as seguintes afirmações:
I – As reações de decomposição dos óxidos de nitrogênio a gás oxigênio e a gás nitrogênio ocorrem com variação no número de oxidação das espécies.
II – O CO2 é um óxido ácido que quando reage com a água forma o ácido carbônico.
III – Catalisadores são substâncias que iniciam as reações químicas que seriam impossíveis sem eles, aumentando a velocidade e também a energia de ativação da reação.
IV – O monóxido de carbono é um óxido básico que ao reagir com a água forma uma base.
V – A molécula do gás carbônico apresenta geometria espacial angular.
Das afirmativas feitas estão corretas apenas:
Um mineral muito famoso, pertencente ao grupo dos carbonatos, e que dá origem a uma pedra semipreciosa é a malaquita, cuja a fórmula é: Cu2(OH)2CO3 (ou CuCO3.Cu(OH)2).
Experimentalmente pode-se obter malaquita pela reação de precipitação que ocorre entre soluções aquosas de sulfato de cobre II e carbonato de sódio, formando um carbonato básico de cobre II hidratado, conforme a equação da reação:
2 CuSO4 (aq) + 2 Na2CO3 (aq) + H2O (l) → CuCO3.Cu(OH)2 (s) + 2 Na2SO4 (aq) + CO2 (g)
Na reação de síntese da malaquita, partindo-se de 1060 g de carbonato de sódio e considerando-se um rendimento de reação de 90%, o volume de CO2 (a 25 ºC e 1 atm) e a massa de malaquita obtida serão, respectivamente, de:
Dados: – massas atômicas Cu = 64 u; S = 32 u; O = 16 u; Na = 23 u; C = 12 u; H = 1 u.
– volume molar 24,5 L/mol, no estado padrão.
Observe a reação a seguir.
NO2(g) + O3(g) → NO3(g) O2(g)
Dados a 25 °C :
Lei da velocidade: velocidade = k[NO2][O3]
Constante de velocidade (k) : k = 4,4 x 107 dm3 • mol-1 • s-1
[NO2] : concentração de dióxido de nitrogênio (NO2)
[O3] : concentração de ozônio (O3)
A reação química acima ocorre na atmosfera terrestre quando o dióxido de nitrogênio presente no ar poluído entra em contato
com o ozônio. Com relação a este fenômeno químico, é
correto afirmar que:
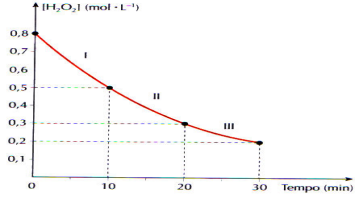 Calcule a velocidade média de decomposição da água
oxigenada, em mol.L-1.min-1, nos intervalos I, II, I e no
intervalo de 0 a 30 min:
Calcule a velocidade média de decomposição da água
oxigenada, em mol.L-1.min-1, nos intervalos I, II, I e no
intervalo de 0 a 30 min: 