Questões de Concurso Militar CIAAR 2021 para Primeiro Tenente - Farmácia Industrial
Foram encontradas 30 questões
As soluções são uma das formulações farmacêuticas mais antigas na história da medicina. São administradas por diferentes vias, que exigem requisitos específicos da formulação. Embora todas as soluções farmacêuticas devam ser estáveis e aceitáveis aos pacientes, alguns requisitos para as soluções podem variar de acordo com características específicas necessárias para cada via de administração.
Associe as colunas corretamente, relacionando a via de administração ao seu requisito específico.
VIAS DE ADMINISTRAÇÃO
(1) Oral
(2) Tópica
(3) Ocular
(4) Nasal
(5) Parenteral
REQUISITOS
( ) Tolera uma faixa de pH estreita, apenas de 5,5 a 6,5; deve ser isotônica em relação ao meio de aplicação e com viscosidade próxima a esse; geralmente são utilizados agentes flavorizantes e adoçantes.
( ) O veículo pode ser aquoso ou não aquoso; coloide elástico em solvente volátil é uma das opções de formulação, onde o solvente evapore rápido após aplicação, deixando um filme polimérico no local.
( ) Devem ser estéreis e livres de pirogênio e, em geral, ter valor próximo do pH fisiológico, mas uma faixa ampla entre 3 e 9 é bem tolerada, já que a solução é rapidamente diluída no meio de aplicação.
( ) Devem ser soluções aquosas, geralmente com pH neutro, embora uma faixa entre 2 a 9 possa ser tolerada; a viscosidade é fator relevante para a escoabilidade.
( ) A maioria dos compostos é aquosa; devem ser soluções estéreis e conter conservantes antimicrobianos; a rigor, o pH da solução deve ser próximo de 7,4 ou ligeiramente alcalino, mas questões relacionadas à solubilidade, absorção e estabilidade do fármaco podem requerer outras faixas de pH, sendo que o local de aplicação tolera pH de 3,5 a 9 e deve ser isotônica em relação ao meio de aplicação para minimizar irritação e desconforto.
A sequência correta dessa associação é
A Instrução Normativa n°47/2019 é uma norma complementar às Boas Práticas de Fabricação (BPF) definidas pela RDC n° 301/2019 e dispõe das atividades de qualificação e validação. A norma aborda diferentes tipos de validação de processo e abordagens que buscam a realização do produto ao longo do seu ciclo de vida, ou seja, envolve todas as fases da vida útil do produto, desde o desenvolvimento inicial até a descontinuação do uso.
Sobre validação de processo e ciclo de vida do produto, é correto afirmar que
A validação de limpeza na indústria farmacêutica é parte integrante das Boas Práticas de Fabricação (BPF) e deve ser realizada para confirmar a eficácia de qualquer procedimento de limpeza para todos os equipamentos com contato direto com os produtos.
Sobre a validação de limpeza é correto afirmar que
O gráfico mostra uma carta controle hipotética do teste de determinação de peso, obtida durante a análise de Controle Estatístico de Processo, referente ao período de um ano de coleta de dados na revisão de qualidade de um produto (Revisão Periódica de Produto) na forma farmacêutica comprimido.
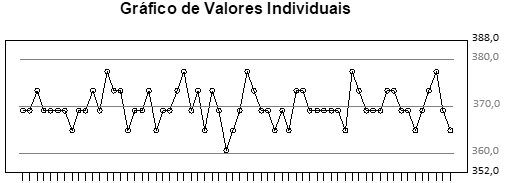
Fonte: Arquivo da Banca Elaboradora.
Pela análise do gráfico, é correto afirmar que
De acordo com o Guia de Qualidade Quality Risk Management do International Conference on Harmonization (ICH-Q9) e com os requisitos de boas práticas de fabricação, o gerenciamento de risco da qualidade é um processo sistemático de avaliação, controle, comunicação e revisão de riscos para a qualidade do medicamento. Para uso na indústria farmacêutica, dois princípios básicos devem ser considerados: ser baseado em conhecimentos científicos e utilizar de documentação e nível de esforço proporcionais ao nível de risco. Nesse sentido, diversas ferramentas de análise de risco de complexidades distintas são comumente utilizadas, devendo ser aplicadas em conformidade com o nível do risco avaliado.
São exemplos de ferramentas de análise de risco, exceto
De acordo com a Resolução da Diretoria Colegiada da Agência Nacional de Vigilância Sanitária - RDC N° 200, de 26 de dezembro de 2017, que dispõe sobre os critérios para a concessão e a renovação do registro de medicamentos com princípios ativos sintéticos e semissintéticos, classificados como novos, genéricos e similares, e dá outras providências, a documentação técnica de qualidade para registro de um medicamento deve incluir relatórios técnicos contendo informações sobre o produto, o processo e os insumos, dentre outros requisitos, considerando que a embalagem primária, aquela que mantém contato direto com o medicamento, é um importante insumo de um produto farmacêutico.
A sequência que apresenta corretamente os requisitos exigidos na documentação técnica relacionada à embalagem primária para registro de medicamentos está indicada em
A Instrução Normativa nº 43, de 21 de agosto de 2019, dispõe sobre as Boas Práticas de Fabricação (BPF) complementares aos sistemas computadorizados utilizados na fabricação de medicamentos. Um sistema computadorizado é um conjunto de software e componentes de hardware que, juntos, cumprem certas funcionalidades.
São determinações para manutenção das BPF relacionadas aos sistemas computadorizados, exceto
Emulsão é uma dispersão de dois líquidos imiscíveis (ou parcialmente miscíveis), sendo um distribuído uniformemente na forma de gotículas finas (a fase dispersa) por meio do outro (a fase contínua). Os líquidos imiscíveis são, por convenção, descritos como “óleo” e “água”, já que, invariavelmente, um dos líquidos é apolar (um óleo, cera ou lipídio) e o outro é polar (água ou uma solução aquosa). Como as emulsões são termodinamicamente instáveis, retornam para fases contínuas separadas de óleo e água, a não ser que sejam cineticamente estabilizadas pela adição de agentes emulsificantes.
São exemplos de agentes emulsificantes típicos utilizados como excipientes de formulações farmacêuticas do tipo óleo/água de emulsões tópicas, exceto
Nas negociações de contratos de fornecimento de doses das vacinas de COVID-19 entre o Ministério da Saúde e os laboratórios produtores, muito se ouviu falar na mídia sobre a responsabilização das partes envolvidas quanto aos danos aos pacientes submetidos à vacinação. Essa responsabilização acontece na fase de farmacovigilância, que contempla as atividades relacionadas à detecção, avaliação, compreensão e prevenção de eventos adversos ou quaisquer outros problemas relacionados a medicamentos. A legislação da Anvisa que regulamenta as atividades de farmacovigilância é a RCD n° 406, de 22 de julho de 2020.
São exigências regulatórias determinadas pela RDC n° 406/2020, exceto