Questões de Concurso Militar EsPCEx 2018 para Cadete do Exército - 1° Dia
Foram encontradas 12 questões
I – as moléculas CO2 e H2O apresentam a mesma geometria molecular. II – a temperatura de ebulição da água é maior que a do CO2, pois as moléculas de água na fase líquida se unem por ligação de hidrogênio, interação intermolecular extremamente intensa. III – a molécula de CO2 é polar e a de água é apolar. IV – a temperatura de fusão do CO2 é maior que a da água, pois, diferentemente da água, a molécula de CO2 apresenta fortes interações intermoleculares por apresentar geometria angular. V – o número de oxidação (Nox) do carbono na molécula de CO2 é +4.
Estão corretas apenas as afirmativas
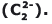
(FONSECA, Martha Reis Marques da, Química Geral, São Paulo: Ed FTD, 2007, pág 330)
O carbeto de cálcio (CaC2), também denominado de carbureto ou acetileto de cálcio, é um sólido duro que reage com a água para produção do gás acetileno (C2H2). A reação que se processa é representada pela seguinte equação não balanceada: CaC2 + H2O C2H2 + Ca(OH)2
Com relação a esta reação, seus reagentes e produtos, são feitas as seguintes afirmativas:
I – o carbeto de cálcio é um composto iônico. II – a nomenclatura oficial da União Internacional de Química Pura e Aplicada (IUPAC) para o acetileno (C2H2) é etino. III – o Ca(OH)2 é classificado como uma base de Arrhenius e tem nomenclatura de hidróxido de cálcio. IV – a soma dos coeficientes da equação corretamente balanceada é 5. V – todos os reagentes e produtos são classificados como substâncias simples.
Dado: número atômico (Z) H = 1; O = 8; Ca = 20; C = 6
Estão corretas apenas as afirmativas
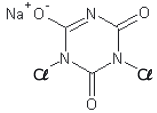
dicloro isocianurato de sódio
Considerando a estrutura apresentada e o texto, são feitas as seguintes afirmativas:
I – em sua estrutura encontra-se o grupo funcional representativo da função nitrocomposto. II – todos os carbonos apresentados na estrutura possuem hibridização sp2. III – sua fórmula molecular é C3Cl2N3NaO3. IV – Considerando-se um cantil operacional contendo 1000 mL de água, será necessário mais que uma unidade do comprimido para desinfecção completa dessa água.
Das afirmativas feitas estão corretas apenas:
Considerando que: - a solução básica foi parcialmente neutralizada pela solução do ácido; - o ácido clorídrico é um ácido forte (α=100%); - o hidróxido de sódio é uma base forte (α=100%).
O pH da mistura resultante dessa reação de neutralização é
Dado: log 4 = 0,60

Considere as afirmativas acerca dos elementos hipotéticos (A, B, C) apresentados na Tabela Periódica.
I – Dentre os elementos hipotéticos, o elemento A é o de maior afinidade eletrônica (“energia liberada quando um átomo isolado, no estado gasoso, captura um elétron”). USBERCO, João e SALVADOR, Edgard. Química, Vol. 2: Físico-Química. 12ª ed. Reform - São Paulo: Ed. Saraiva, 2009, pág. 202.
II – Dentre os elementos hipotéticos, pode-se afirmar que o elemento B é o de maior eletropositividade (“capacidade de um átomo perder elétrons, originando cátions”). USBERCO, João e SALVADOR, Edgard. Química, Vol. 2: Físico-Química. 12ª ed. Reform - São Paulo: Ed. Saraiva, 2009, pág. 203.
III – Dentre os elementos hipotéticos, pode-se afirmar que o elemento C é o mais eletronegativo (“força de atração exercida sobre os elétrons de uma ligação”).
USBERCO, João e SALVADOR, Edgard. Química, Vol. 2: Físico-Química. 12ª ed. Reform - São Paulo: Ed. Saraiva, 2009, pág. 202.
Das afirmativas feitas está(ão) correta(s) apenas
Acerca da espécie química CaWO4 e seus átomos constituintes, são feitas as seguintes afirmativas:
I – No composto CaWO4 o número de oxidação (Nox) do tungstênio é +6. II – O composto CaWO4 é considerado um peróxido. III – O CaWO4 é uma substância que possui apenas ligações do tipo covalente. I V – O tungstênio (Z=74) é um metal de transição externa (“elementos com configuração eletrônica terminando em ns2 (n-1)d1 até 10”). FONSECA, Martha Reis Marques da, Química Geral, São Paulo: Ed FTD, 2007, pág 206.
Das afirmativas feitas estão corretas apenas

A alternativa que descreve, respectivamente, a correta nomenclatura oficial destes ácidos é:
Um analista precisava neutralizar uma certa quantidade de ácido sulfúrico (H2SO4) de seu laboratório e tinha hidróxido de sódio (NaOH) à disposição para essa neutralização. Ele realizou a mistura de 245 g de ácido sulfúrico com 100 g de hidróxido de sódio e verificou que a massa de um dos reagentes não foi completamente consumida nessa reação. Sabendo-se que o reagente limitante foi completamente consumido, a massa do reagente que sobrou como excesso após a reação de neutralização foi de
Dado: massa atômica do H= 1 u; O= 16 u; Na= 23 u; Cl=35,5 u
Dados: massa molar do cobre = 64 g · mol-1 ; 1 Faraday = 96500 C · mol-1
αA + βΒ + χC D + E
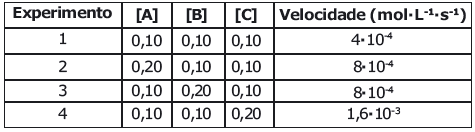
A partir dos resultados experimentais apresentados na tabela, pode se afirmar que a expressão da equação da lei da velocidade (V) para essa reação química é

I – O agente oxidante dessa reação é o O2.
II – O coeficiente estequiométrico da água, após o balanceamento da equação, é 2.
III – Considerando a densidade do etanol 0,8 g/mL (25 ºC; 1 atm), a combustão completa de 1150 mL desse composto libera aproximadamente 27360 kJ.
IV – A quantidade de calor liberada na combustão de 1 mol de etanol é de 278 kJ·mol-1.
Das afirmativas feitas estão corretas apenas
Dados: massa atômica de cobre 64 u ; volume molar nas CNTP: 22,7 L