Questões de Concurso Militar CAP 2017 para Cabo - Técnico em Química
Foram encontradas 50 questões
A que temperatura a velocidade média das moléculas de um gás que está a 27°C irá duplicar?
Dado:
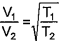
Analise o composto abaixo.
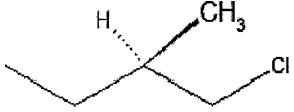
De acordo com o Sistema de Nomenclatura de
Enantiômeros de Cahn-Ingold-Prelog, o nome correto do
composto acima é:
Analise a seguinte reação.
2NO2(g) ⇄ N2O4(g) ΔH = -57,2 kJ/mol
Na reação acima, o equilíbrio se desloca para a esquerda
quando, considerando conjuntamente os efeitos da
compressão e temperatura sobre o sistema:
O resultado da soma abaixo, considerando os algarismos significativos, é:
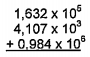
Analise as reações abaixo.
NH4+ + H2O = NH3 + H3O+
[AI(H2O)4]3+ + H2O = [Al(H2O )3OH]2+ + H3O +
De acordo com a teoria de Brõnsted-Lowry, NH3 e [AI(H2O)4]3+, nas reações acima, são considerados, respectivamente:
Considere a seguinte substância:

Com relação à reação abaixo, considerando a tabela acima e o pH da água igual a 7,00, assinale a opção correta.
CH3NH2(aq) + H2O(I) ⇄ CH3NH+3(aq) + OH-(aq)
Analise a reação abaixo.
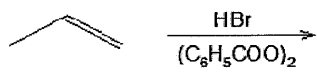
Na reação de adição de HBr ao propeno acima, o produto da reação é:
(Obs: (C6H5COO)2 é o peróxido de benzoílo.)
Calcule o potencial da célula Zn|ZnSO4||CuSO4|Cu e indique se a reação Zn(s)+ Cu2+ -> Zn2+ + Cu(s) ocorre de forma espontânea ou não, marcando a opção correta.
Dados: E0Cu = +0,337V; E0Zn = -0.763V
Analise o composto abaixo.
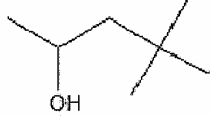
A nomenclatura IUPAC desse composto é:
Considere os seguintes álcoois:
I- n-butílico
II- iso-butílico
III- sec-butílico
IV- terc-butílico
Assinale a opção que apresenta os compostos acima em ordem crescente de ponto de ebulição.
Analise os potenciais padrão dos eletrodos de prata e zinco abaixo.
Ag+ + e- ↔ Ag E° = + 0,7999 V
Zn2+ + 2e- ↔ Zn E° = - 0,763 V
Assinale a opção que apresenta a reação da pilha dos
potenciais padrão acima.
Calcule a f.e.m. de uma célula formada pela imersão de uma lâmina de cobre numa solução de 0,15M de CuSO4 e um bastão de zinco numa solução de 0,25M de ZnSO4 e marque a opção correta.
Dados:
Equação de Nernst: E = E0 + (0,0592/n) x log M
Cu2+ + 2e- = Cu; E0Cu = 0,34V
Zn2+ + 2e- = Zn; E0Zn = -0,76V
log(0,15) = -0,82391
log(0,25) = -0,60206