Questões Militares
Foram encontradas 304 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Três frascos foram encontrados sem rótulo na bancada de um laboratório. Um deles continha solução de KOH a 0,1 mol/L; o outro, solução de CaCl2 a 0,05 mol/L; e o outro, solução de CH3CH2COOH a 0,1 mol/L. Na tentativa de identificar a solução contida em cada um deles, um técnico usou volumes iguais das soluções dos frascos para medir a pressão de vapor sob mesma temperatura, utilizando um sistema adequado. Os resultados obtidos estão indicados pelos ponteiros dos manômetros nesta figura.
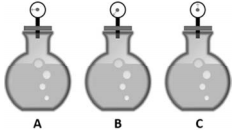
Com base nas informações e na figura apresentadas, é correto
afirmar que os frascos identificados por A, B e C contêm,
respectivamente, as soluções de
Visando estudar o equilíbrio a seguir, um experimentador adicionou quantidades equimolares de tricloreto de fósforo e cloro gasoso em um reator a 180 °C.
PCl3(g) + Cl2(g) ⇌ PCl5(g)
Atingido o equilíbrio, foi verificada uma concentração de 1 x 10−4 mol/L de pentacloreto de fósforo.
Admitindo que, a 180 °C, a constante do equilíbrio em apreço
seja igual a 0,64, assinale a opção que indica a concentração de
cloro gasoso presente no equilíbrio.
Industrialmente, o PCl5 é sintetizado em reator fechado por meio da cloração do PCl3, de acordo com a equação química a seguir.
PCl3(g) + Cl2(g) ⇌ PCl5(g) ΔH = −124 kJ/mol
Conforme o princípio de Le Châtelier, o rendimento desse
processo pode ser aumentado
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

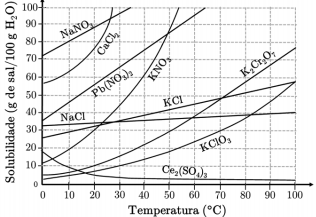
I. Dissolvendo-se 130 g de KNO3 em 200 g de água, a 40 °C, obteremos uma solução saturada com depósito de 70 g desta substância que não será dissolvida. II. Se dissolvermos 20 g de Ce2(SO4)3 em 300 g de água a 10 °C e, posteriormente, aquecermos esta solução a 90 °C, haverá gradativa precipitação da substância. III. A menor quantidade de água necessária para dissolver completamente 140 g de K2Cr2O7 a 90 °C é, aproximadamente, 150 g. IV. NaNO3 é a substância mais solúvel a 30 °C.
Das afirmações acima, está(ão) CORRETA(S)