Questões Militares
Comentadas para cbm-es
Foram encontradas 310 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A ocorrência de fermentação lática restringe-se aos músculos estriados, esqueléticos e cardíacos.
Embora uma célula muscular não tenha como armazenar a energia produzida (ATP) em excesso durante o repouso, em razão da instabilidade da molécula, parte dessa energia pode ser armazenada na forma de fosfocreatina.
A imunoterapia teria o mesmo sucesso caso fossem utilizados linfócitos de outro indivíduo, uma vez que a resposta imunitária no tecido afetado seria a mesma.
Com base na equação da reação química que ocorre no borbulhador, é correto afirmar que o peróxido de hidrogênio atuou no processo como agente oxidante.
Considerando que, na titulação do ácido sulfúrico formado no borbulhador, foram gastos 3,2 mol de NaOH e que o totalizador de volume indicou 4 m3 de amostra de ar, conclui-se que, nessa análise, a concentração de dióxido de enxofre no ar amostrado era de 8 × 10-4 mol / L.
O método de separação de misturas representado pelo dispositivo 2, representado na figura, também é eficaz para a separaração dos componentes da solução resultante do processo de titulação empregado na dosagem do ácido sulfúrico.
O dióxido de enxofre, além ser um poluente atmosférico associado à formação de precipitações ácidas, tem destacado papel como gás estufa, influindo no aquecimento global.
Da análise da estrutura do dióxido de carbono (CO2) , conclui-se que, apesar de a ligação entre C e O ser polar, a molécula é apolar pelo fato de sua geometria ser linear.
O raio do íon sódio (Na+) é inferior ao do íon potássio (K+).
O fato de o carbono na molécula de CO2 apresentar estado de oxidação o mais reduzido possível corrobora a informação mencionada no texto de que essa substância não atua como combustível.
O bicarbonato de sódio é um hidrogenossal que apresenta, em sua estrutura, ligações iônicas e covalentes.
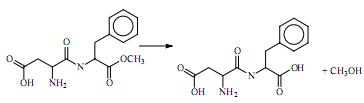
Considerando-se que o aspartame se degrada em aspartilfenilalanina e metanol sob exposição prolongada ao calor, de acordo com a equação química a seguir, é correto afirmar que, nessas condições, a molécula de aspartame sofre oxidação.
A maior solubilidade em água do benzoato de sódio em relação ao ácido benzoico deve-se, especialmente, ao fato de o grupo carboxilato ser mais hidrofílico que o grupo carboxila.
De acordo com o texto, a concentração máxima de ácido benzoico permitida em bebidas refrigerantes é superior a 40 mmol/L.
Infere-se da estrutura do aspartame, apresentada acima, que estão presentes, em sua composição, as funções ácido carboxílico, amina, amida e éter.
Dos combustíveis citados na tabela, o hidrogênio apresenta o maior poder calorífico por mol de combustível queimado.
Classifica-se como acíclica, homogênea, ramificada e saturada a cadeia carbônica do isoctano.
A equação química C2H6O + 2O2 → 2CO + 3H2O expressa corretamente a reação de combustão completa do etanol.
Sendo o metilpropano isômero do butano, esses dois hidrocarbonetos, nas mesmas condições experimentais, apresentam o mesmo poder calorífico.
Considerando-se que o rendimento da reação completa de combustão do butano seja de 100%, é correto afirmar que, para a queima completa de 116 g desse hidrocarboneto, seria necessária massa mínima de oxigênio superior a 410 g.





