Questões de Concurso
Sobre balanço de massa e energia em engenharia química e química industrial
Foram encontradas 208 questões
Considere o que se afirma sobre radiação térmica.
I. É a energia emitida pela matéria que está a uma temperatura não nula. A emissão pode ocorrer a partir de gases, líquidos e superfícies sólidas. A radiação também pode incidir sobre uma superfície a partir de suas vizinhanças.
II. A emissão pode ser atribuída a alterações nas configurações eletrônicas dos átomos ou moléculas que constituem a matéria.
III. A transferência por radiação ocorre mais dificilmente no vácuo.
IV. O fluxo térmico emitido por uma superfície real é maior do que aquele emitido por um corpo negro à mesma temperatura.
V. A emissividade é uma propriedade que depende do material da superfície, mas independe de seu acabamento.
Assinale a alternativa em que todas a(s) afirmativa(s) está(ão) CORRETA(S):


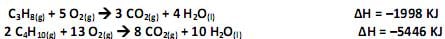
A sequência está correta em
· Reação 1: C6H12O6 →2 C2H5OH + 2 CO2
· Reação 2: C6H12O6 →2 C2H3CO2H + 2 H2O
Em um processo batelada, o fermentador é carregado com 4000 kg de uma solução de glicose a 12% em água. Após a fermentação, 120 kg de CO2 foram produzidos, permanecendo no mosto 90 kg de glicose não convertida. Sobre esse processo, analise.
I. O balanço material para o componente i é
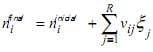
II. O número de graus de liberdade é zero.
III. O processo é transiente em sistema fechado.
Está(ão) correta(s) a(s) afirmativa(s)
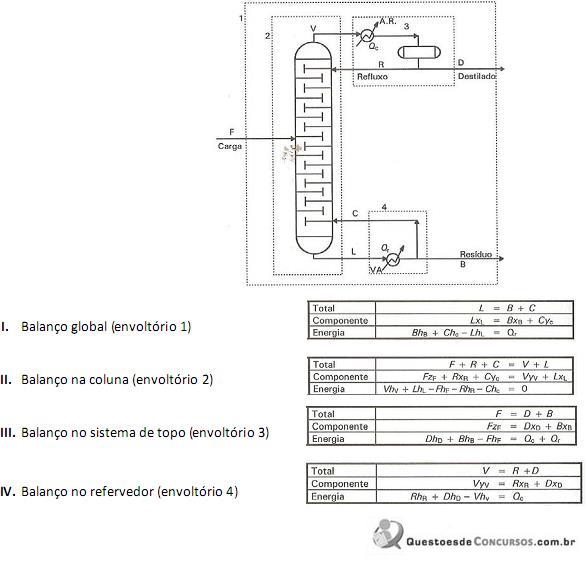
( ) Na operação absorção gasosa, uma corrente gasosa é alimentada continuamente pela parte inferior de um equipamento absorvedor e escoa em contracorrente com um líquido solvente que é admitido pelo topo da torre.
( ) A extração líquido-líquido é usada quando se deseja remover de uma mistura de líquidos um ou mais componentes, denominado(s) soluto(s), através do contato direto com um líquido conhecido como solvente, que é miscível com a mistura original (a carga) e remove totalmente os componentes desejados da carga.
( ) A adsorção é usada quando se deseja remover de uma mistura de líquidos ou de gases um ou mais componentes através do contato direto com um líquido.
( ) O tipo mais simples de secador é o secador de bandeja que opera em batelada e é, normalmente, usado para operações em pequena escala.
A sequência está correta em
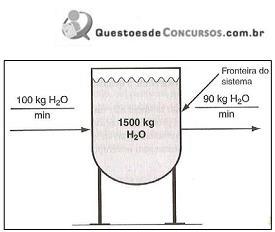
De acordo com as informações anteriores, analise.
I. O acúmulo representará a soma de todo o material que se acumulou no sistema durante esse intervalo de tempo.
II. As condições das correntes em escoamento não variam no tempo.
III. O balanço material para o processo é: acúmulo de material dentro do sistema = total de material alimentado no sistema — total de material retirado do sistema.
Está(ão) correta(s) a(s) afirmativa(s)
Um tanque rígido, termicamente isolado, está conectado a duas tubulações, ambas equipadas com válvulas. Uma dessas tubulações é uma linha com vapor d’ água a 1000 kPa e 600 K. A outra é uma linha conectada a uma bomba de vácuo. As duas válvulas estão inicialmente fechadas. A válvula para a bomba de vácuo é então aberta lentamente, de modo a evacuar o tanque por completo. Essa válvula é então fechada. A seguir, abre‐se lentamente a válvula da linha de vapor permitindo a entrada cuidadosa de vapor para o tanque evacuado, até que a pressão deste esteja equalizada à pressão da linha de vapor.
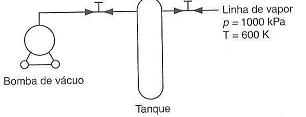
Para o processo descrito, marque V para as afirmativas verdadeiras e F para as falsas.
( ) O tanque é um sistema aberto estacionário.
( ) O balanço geral de energia pode ser representado pela equação UT2 - 0= - ( Hsai – Hentra).
( ) Há transferência de calor no processo.
( ) Inicialmente, não há massa no sistema, de modo que UT1 = 0.
A sequência está correta em
Em geral, a conservação de massa total requer que o somatório dos fluxos difusivos de todas as espécies seja maior que um.
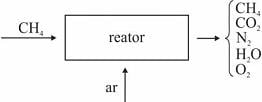
Em um reator ideal, de processo contínuo, que opera em estado estacionário, a combustão de
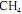 ocorre com uma conversão de 90% do reagente limitante. Esse reator é alimentado com
ocorre com uma conversão de 90% do reagente limitante. Esse reator é alimentado com 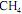 e ar a taxas de 16 kg/h e 300 kg/h, respectivamente, conforme ilustrado no esquema apresentado.
e ar a taxas de 16 kg/h e 300 kg/h, respectivamente, conforme ilustrado no esquema apresentado. Considerando que, nessa situação, a combustão do
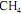 seja completa e que a composição do ar que alimenta o reator seja de 24%, em massa, de
seja completa e que a composição do ar que alimenta o reator seja de 24%, em massa, de 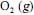 e, o restante, de
e, o restante, de 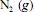 , julgue o item subsequente.
, julgue o item subsequente.A porcentagem, em massa, de
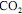 na corrente de saída do reator é superior a 10%.
na corrente de saída do reator é superior a 10%. Considere que em uma solução de tiossulfato de sódio (Na2S2O3) foi padronizada por meio da dissolução de 0,1g de KIO3 em água, da adição de um grande excesso de KI e acidificação com HCl. O iodo liberado consumiu 50mL da solução de tiossulfato para descolorir o complexo azul de amido-iodo.
Nessas condições é CORRETO afirmar que a concentração do Na2S2O3 é aproximadamente igual a
Ao utilizar um padrão primário hipotético X na padronização de uma solução de hidróxido de sódio (NaOH), a reação de neutralização ocorre na proporção estequiométrica de 1 para 1. Considere que foram gastos 25mL da solução de NaOH 0,1mol/L na titulação e foi consumido 0,5 gramas do padrão.
Nessas condições é CORRETO afirmar que a massa molar do padrão primário escolhido é igual a
Considere que um técnico preparou 100mL de uma solução de HCl 0,1 mol/L para uma aula prática. Ao ler o roteiro da prática que estava montando, percebeu que precisava, na verdade, de 500mL de 0,5mol/L de HCl. Para reparar seu erro, o técnico aproveitou a solução que tinha preparado, acrescentando a ela uma alíquota da solução estoque e completou o volume com água para 500mL.
Nessas condições, é CORRETO afirmar que o volume do estoque (alíquota) necessário para preparar a solução de 0,5mol/L é igual a
Dados da solução estoque: densidade = 1,2g/mL; percentual de HCl em massa = 36,5%
Um tanque de aço é preenchido com 280 kg de gás nitrogênio a temperatura de 300 K. Este reservatório é submetido a processo de aquecimento até atingir a temperatura de 400 K. Considerando que nas condições do problema o N2 se comporta como gás ideal, indique qual a variação na energia interna, em kJ, do gás. Dados: capacidade calorifica do N2, em J . mol-1 . K-1, Cp = 30,354; R = 8,314 J mol-1 K-1 e a massa atômica, em g mol-1, N=14.
Em uma sala de 300 m3 que possui umidade relativa de 60%, o ar está a 27°C e a 102,2 kPa. Nessa temperat ura, considere que a pressão de vapor da água é, aproximadamente, de 4 kPa e a razão de umidade é de 0,02 kg de água por kg de ar seco. A massa de vapor d’água presente na sala é de
Dados adicionais: R = 8,314 kJ.kmol-1.K-1; Massa molar do ar: 29 kg.kmol-1
A adição de íons fluoretos a água potável tem como objetivo prevenir o surgimento de cáries na população. Devido a possível toxicidade quando em doses elevadas, à concentração deste íon na água para consumo humano não deve ultrapassar o valor limite de 1 mg . L-1. Esta concentração pode também ser representada por
Tabela: Composição mássica do gás natural analisado
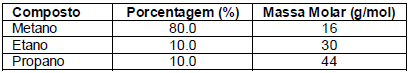
De acordo com esses dados, a fração molar obtida para o metano, etano e o propano são, respectivamente,