Questões de Concurso
Sobre bioquímica em engenharia química e química industrial em engenharia química e química industrial
Foram encontradas 76 questões
· Reação 1: C6H12O6 →2 C2H5OH + 2 CO2
· Reação 2: C6H12O6 →2 C2H3CO2H + 2 H2O
Em um processo batelada, o fermentador é carregado com 4000 kg de uma solução de glicose a 12% em água. Após a fermentação, 120 kg de CO2 foram produzidos, permanecendo no mosto 90 kg de glicose não convertida. Sobre esse processo, analise.
I. O balanço material para o componente i é
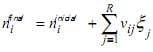
II. O número de graus de liberdade é zero.
III. O processo é transiente em sistema fechado.
Está(ão) correta(s) a(s) afirmativa(s)
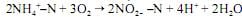
A oxidação dos nitritos a nitratos se dá, principalmente, pela atuação das bactérias, como as do gênero nitrobacter, conforme a reação:
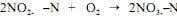 Considerando essas informações, julgue o item a seguir.
Considerando essas informações, julgue o item a seguir. A reação global da nitrificação é a soma das equações da transformação da amônia em nitritos com a equação da oxidação dos nitritos, isto é, NH4+SN + 2O2 → NO3- N + 2H+ + 6H2O.
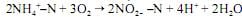
A oxidação dos nitritos a nitratos se dá, principalmente, pela atuação das bactérias, como as do gênero nitrobacter, conforme a reação:
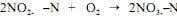 .Considerando essas informações, julgue o item a seguir.
.Considerando essas informações, julgue o item a seguir.Na predominância de anabolismo, a matéria orgânica presente na água residuária é utilizada pelos microrganismos para as suas atividades metabólicas de crescimento e obtenção de energia, fase que resulta no consumo de oxigênio e no aumento da população de microrganismos. A seguinte reação descreve essa etapa:
8CH2O + NH3 + 3O2 → C6H8NO3 + 3CO2 + H2O + energia.
Com referência a esse assunto, julgue o seguinte item, acerca do tratamento de resíduos industriais.
O tratamento biológico de resíduos fundamenta-se na utilização de compostos tóxicos como substrato para crescimento e manutenção de microrganismos. A principal aplicação desse tipo de tratamento é a remoção da matéria orgânica presente nos rejeitos.
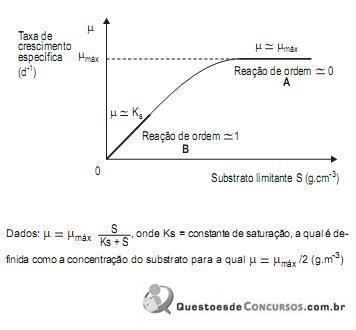
Analisando-se as regiões A e B da curva, conclui-se que nas condições de
I. Substâncias, como cloretos dissolvidos nos efluentes, influenciam no resultado da DQO, sendo necessária uma correção levando em conta este problema.
II. Enquanto que na determinação da DQO se utiliza um oxidante forte como uma mistura de dicromato de potássio e ácido sulfúrico, na determinação da DBO, o oxidante utilizado é o oxigênio e a oxidação requer a interferência de bactérias.
III. A determinação da DBO, para um mesmo efluente, é sempre mais rápida do que a determinação da DQO.
IV. A diferença entre a DQO e a DBO indica aproximadamente a porcentagem de matéria orgânica nãobiodegradável presente no efluente.
V. DQO e DBO medem a quantidade de oxigênio dissolvido nos efluentes através de processos químicos e biológicos respectivamente.
Sobre estes métodos é correto o que se afirma em
ρ = 1000 kg/m³; μ = 1 kg/m.s; ε = 0,15 mm; equação de Bernoulli simplificada:


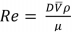
Onde Pé a pressão nos pontos 1 e 2, D o diâmetro do
tubo, L o comprimento do tubo, ρ a densidade, μ a
viscosidade do fluido, ε a rugosidade do tubo, f o
fator de fricção e 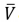 a velocidade média do fluido no
interior do tubo, a queda de pressão ao longo do tubo
pode ser estimada em:
a velocidade média do fluido no
interior do tubo, a queda de pressão ao longo do tubo
pode ser estimada em:
Considerar o seguinte problema para resolução da questão.
Em uma indústria de processamento de alimentos, o vinagre (a densidade do vinagre é 1080 kg / m3) é bombeado do porão para um tanque superior a uma altura de 7 m, com uma vazão de 700 L / min. Desconsiderando o atrito e outras perdas, torna-se possível determinar alguns valores.
O trabalho realizado por minuto é:
1 N2(g) + 3 H2(g) → 2 NH3(g)
Sobre essa reação, são feitas as seguintes afirmações:
I. Quando são misturados 35 g de cada reagente, o reagente limitante é o gás nitrogênio. II. A massa de amônia produzida na reação de 140 g de gás nitrogênio com quantidade suficiente de gás hidrogênio é de 170 g de amônia. III. O volume de amônia, nas CNTP, produzido na reação de 140 g de gás nitrogênio com quantidade suficiente de gás hidrogênio é de 112 L de amônia. IV. Quando 5 mol de gás nitrogênio são colocados para reagir com a quantidade estequiométrica de oxigênio, obtém-se 136 g de amônia se o rendimento for de 80%.
Quais estão corretas?
C8H18(g) + O2 (g) → CO2 (g) + H2O(l) C8H18(g) + O2 (g) → CO (g) + H2O(l) C8H18(g) + O2 (g) → C (g) + H2O(l) __________________________________________________ C8H18(g) + O2 (g) → CO2 (g) + CO (g) + C (g) + H2O(l)
De acordo com as reações químicas apresentadas, determine a massa de monóxido de carbono, expressa em kg, produzida durante a combustão de 10 litros de isooctano. Dados: H = 1,0 g/L; C = 12,0 g/L; O = 16,0 g/L.