Questões de Concurso
Sobre legislação federal, normas e resoluções do cff em farmácia
Foram encontradas 1.780 questões
Segundo a Lei nº 13.021/14, no âmbito da assistência farmacêutica, as farmácias de qualquer natureza requerem, obrigatoriamente, para seu funcionamento, a responsabilidade e a assistência técnica de farmacêutico habilitado. Obriga-se o farmacêutico, no exercício de suas atividades, a:
I. proceder ao acompanhamento farmacoterapêutico de pacientes, internados ou não, em estabelecimentos hospitalares ou ambulatoriais, de natureza pública ou privada;
II. estabelecer o perfil farmacoterapêutico no acompanhamento sistemático do paciente, mediante elaboração, preenchimento e interpretação de fichas farmacoterapêuticas;
III. prestar orientação farmacêutica, com vistas a esclarecer ao paciente a relação entre benefício e risco, a conservação e a utilização de fármacos e medicamentos inerentes à terapia, bem como suas interações medicamentosas e a importância de seu correto manuseio.
Está correto o que se afirma em:
Considerando as diretrizes da Resolução-RDC nº 20/11, que dispõe sobre o controle de medicamentos à base de substâncias classificadas como antimicrobianos, de uso sob prescrição, isoladas ou em associação, julgue as afirmativas verdadeiras (V) ou falsas (F).
( ) A prescrição de medicamentos antimicrobianos deverá ser realizada em receituário privativo do prescritor ou do estabelecimento de saúde, não havendo, portanto, modelo de receita específico.
( ) A receita poderá conter a prescrição de outras categorias de medicamentos desde que não sejam sujeitos a controle especial. Não há limitação do número de itens contendo medicamentos antimicrobianos prescritos por receita.
( ) A dispensação em farmácias e drogarias públicas e privadas se dará mediante a retenção da 2ª (segunda) via da receita, devendo a 1ª (primeira) via ser devolvida ao paciente. As receitas somente poderão ser dispensadas pelo farmacêutico quando apresentadas de forma legível e sem rasuras.
( ) No ato da dispensação devem ser registrados nas duas vias da receita os seguintes dados: a data da dispensação; a quantidade aviada do antimicrobiano; o número do lote do medicamento dispensado; reações adversas potenciais do produto; e a rubrica do farmacêutico, atestando o atendimento, no verso da receita.
Pode-se afirmar que
Considere o procedimento abaixo, descrito na Farmacopeia Brasileira, 5ª edição (Anvisa, 2010), para o doseamento de cloridrato de pilocarpina (C11H16N2O2.HCl) matéria prima.
Pesar, exatamente, cerca de 2 g de amostra e dissolver em 60 mL de água. Titular com hidróxido de sódio M SV e determinar o ponto final potenciometricamente. Cada mL de hidróxido de sódio M SV equivale a 244,720 mg de C11H16N2O2.HCl.
O volume de hidróxido de sódio M SV a ser gasto na titulação de 2,1 g de cloridrato de
pilocarpina é
Um teste de uniformidade de doses unitárias foi realizado segundo o método geral 5.1.6 da Farmacopeia Brasileira, 5ª edição (Anvisa, 2010), e foram obtidos os seguintes valores:
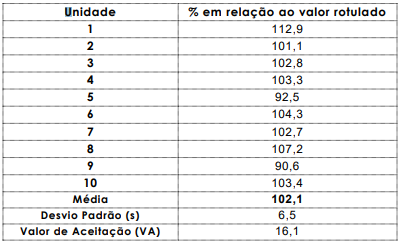
Com base nesses dados, conclui-se que
Considere a informação presente no texto abaixo.
Segundo a Farmacopeia Brasileira, 5ª edição (Anvisa, 2010), a máxima diluição válida (MDV) é "a máxima diluição permitida da amostra em análise onde o limite de endotoxina pode ser determinado. Ela se aplica para injeções ou soluções de administração parenteral na forma reconstituída ou diluída para administração, quantidade de fármaco por peso, se o volume da forma da dosagem for variável".
Para o produto Ciprofloxacino solução injetável 2 mg/mL, o limite de endotoxinas é 1,76 UE/mL. Utilizando-se um reagente LAL de sensibilidade rotulada (λ), de 0,25 UE/mL, o valor da MDV para esse teste é
O procedimento a seguir é descrito na Farmacopeia Brasileira, 5ª edição (Anvisa, 2010) para a avaliação de substâncias relacionadas na monografia de Varfarina matéria prima .
Substâncias relacionadas. Proceder conforme descrito em Cromatografia em camada delgada (5.2.17.1), utilizando sílica-gel GF254, como suporte, e mistura de ácido acético glacial, cloreto de metileno e cicloexano (20:50:50) como fase móvel. Aplicar, separadamente, à placa, 20 μL de cada uma das soluções, recentemente preparadas, descritas a seguir.
Solução (1): dissolver 0,20 g da amostra em acetona e diluir para 10 mL com o mesmo solvente.
Solução (2): diluir 2 mL da Solução (1) em 10 mL de acetona.
Solução (3): diluir 1 mL da Solução (2) em 200 mL de acetona.
Solução (4): dissolver 40 mg de varfarina SQR em acetona e diluir para 10 mL com o mesmo solvente.
Solução (5): transferir 10 mg de acenocumarol SQR e 1 mL da Solução (1) para balão volumétrico de 10 mL, diluir com acetona e completar o volume com o mesmo solvente.
Desenvolver o cromatograma. Remover a placa, deixar secar ao ar. Examinar os
cromatrogramas obtidos sob luz ultravioleta (254 nm). Qualquer mancha obtida no
cromatograma com a Solução (1), com exceção da mancha principal, não pode ser mais
intensa que a obtida no cromatograma com a Solução (3) (___%). O teste não é válido a
não ser que o cromatograma obtido com a Solução (5) mostre duas manchas claramente
separadas e que a mancha do cromatograma obtida com a Solução (3) seja claramente
visível.
O limite individual de substâncias relacionadas para a Varfarina, em porcentagem, é
As Parcerias para o Desenvolvimento Produtivo (PDP) visam ampliar o acesso a medicamentos e produtos para saúde considerados estratégicos para o Sistema Único de Saúde (SUS), por meio do fortalecimento do complexo industrial do país. O objetivo principal é financiar o desenvolvimento nacional para reduzir os custos de aquisição dos medicamentos e produtos que atualmente são importados ou que representam um alto custo para o sistema. Tendo como base a RDC 2531 de 2014, considere as afirmações abaixo.
I As PDP são parcerias que envolvem a cooperação mediante acordo entre instituições públicas e entre instituições públicas e entidades privadas para desenvolvimento, transferência e absorção de tecnologia, produção, capacitação produtiva e tecnológica do país em produtos estratégicos para atendimento às demandas do SUS.
II No caso da empresa detentora da tecnologia utilizar o insumo farmacêutico ativo (IFA) internacional, a empresa a internalizar a tecnologia deve manter o IFA internacional após conclusão da internalização.
III Para a primeira aquisição, o registro sanitário do produto objeto da PDP poderá ser da instituição pública ou da entidade privada, desde que esteja em processo comprovado de desenvolvimento, transferência e absorção de tecnologia.
IV O ano 1 da PDP se iniciará a partir da assinatura do termo de compromisso e formalização de acordo ou contrato entre as partes, iniciando as etapas de desenvolvimento, transferência e absorção de tecnologia do produto objeto da PDP com observância dos critérios, diretrizes e orientações da RDC 2531 supra mencionada.
Em relação ao exposto, estão corretas as afirmações