Questões de Concurso
Sobre química analítica e espectroscopia em farmácia
Foram encontradas 454 questões

I. A precisão, em validação analítica, abrange a repetibilidade, precisão intermediária e reprodutibilidade.
II. O limite de quantificação é o menor valor determinado, em confiabilidade de precisão e exatidão aceitáveis, para aquela condição analítica; já o limite de detecção é calculado, na prática, como sendo correspondente à concentração que produziria um valor do sinal medido 10 vezes maior que o nível de ruído médio medido com a solução de controle ou branco.
III. A exatidão de um método expressa a concordância entre o valor encontrado na medição e o valor aceito como verdadeiro ou referência; a precisão representa o grau de dispersão de resultados entre ensaios independentes, repetidos de uma mesma amostra, amostras semelhantes ou padrões, sob condições definidas.
IV. A reprodutibilidade representa a máxima diferença aceitável entre duas repetições – dois resultados independentes – do mesmo ensaio e no mesmo laboratório, sob as mesmas condições; já a repetibilidade é a máxima diferença aceitável entre dois resultados individuais, um em cada um de dois laboratórios, para um mesmo processo e com demais condições de acordo com o especificado.
Selecione a alternativa que representa o conjunto de afirmativas corretas.
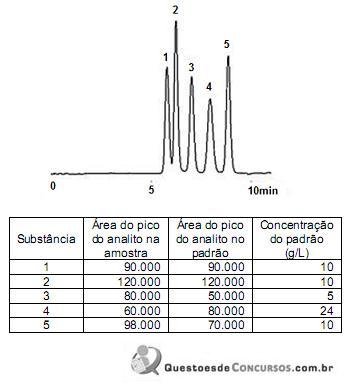
De acordo com esses dados, é correto afirmar que a(s)

