Questões de Concurso
Comentadas sobre cinética química em química
Foram encontradas 538 questões
I. A pressão final será menor que a inicial pois houve a diminuição da temperatura do experimento. II. A pressão final será maior apesar de haver a diminuição da temperatura do experimento. III. A pressão final será menor que a inicial, pois na reação que ocorre no experimento, o número de mols do gás diminui, conforme Lei de Avogadro. IV. Não há alteração na pressão final, pois com a reação que ocorre no experimento, o número de mols do gás diminui enquanto a pressão aumenta, um compensando o outro.
Estão corretas as afirmativas:
Assinale a alternativa que preencha correta e respectivamente as lacunas.
Assinale a alternativa que melhor representa quantas meias-vidas são necessárias para decompor 99% de uma amostra:
Foram feitos três experimentos para o estudo cinético da reação entre os gases monóxido de nitrogênio e hidrogênio que ocorre de acordo com a reação a seguir.
2NO (g) + 2 H2 (g) → N2 (g) + 2H2 O (g)
A evolução da reação foi monitorada por técnica experimental medindo-se a formação dos produtos.
A tabela apresenta as concentrações dos reagentes e as velocidades iniciais das reações, para os três experimentos.
Experimento |
[NO] (mol.L–1) |
[H2] (mol.L–1) |
Velocidade inicial (mol.L–1.s–1) |
1 |
5 × 10–3 |
2 × 10–3 |
1,25 × 10–5 |
2 |
10 × 10–3 |
2 × 10–3 |
5 × 10–5 |
3 |
10 × 10–3 |
1 × 10–3 |
2,5 × 10–5 |
A ordem global dessa reação e as unidades de sua constante de velocidade são, correta e respectivamente:
Em uma aula prática de bioquímica, para medir a atividade catalítica da enzima catalase, foram realizados seis ensaios independentes, nas mesmas condições, variando-se apenas a temperatura. A catalase decompõe o peróxido de hidrogênio (H2O2), produzindo água e oxigênio. Os resultados dos ensaios estão apresentados no quadro.
|
Ensaio |
Temperatura (°C) |
Resultado |
Decomposição de H2O2 (min10−12mol) | ||
1 |
10 |
8,0 |
2 |
15 |
10,5 |
3 |
20 |
9,5 |
4 |
25 |
5,0 |
5 |
30 |
3,6 |
6 |
35 |
3,1 |
Os diferentes resultados dos ensaios justificam-se pelo(a)
No fenômeno de transferência de massa para uma mistura gasosa binária formada pelos gases A+B, o fluxo molar do componente A na direção z (NA, mol.s-1.m-2) pode ser calculado pela expressão:
NA=NA+NBNA. zDAB . c. ln [(NA+NBNA)−(ccA1)(NA+NBNA)−(ccA2)]
Essa equação é aplicada para difusão na direção de z com NA e NB constantes e em estado estacionário. Nesse contexto, assinale a opção CORRETA.
Na extração líquido-líquido, há a necessidade da determinação de dados de equilíbrio líquido-líquido do sistema de interesse. Um sistema interessante na área de alimentos é a desacidificação de óleos vegetais utilizando solventes orgânicos. O objetivo é utilizar um solvente líquido, como etanol, por exemplo, para retirar os ácidos graxos do óleo vegetal bruto. A figura abaixo apresenta um diagrama de equilíbrio líquido-líquido contendo óleo de girassol + solvente + ácido oleico a 25ºC, sendo que o solvente pode ser etanol puro ou misturado com água.
(Diagrama de equilíbrio líquido-líquido para o sistema contendo óleo de girassol refinado, solvente e ácido oleico a 25 ºC. Fonte: CUEVAS et al., 2010, https:// pubs.acs.org/doi/pdf/10.1021/je900791w. Acesso em 12 de janeiro de 2022.)
De acordo com a figura acima, é INCORRETO afirmar que:
Leia o texto a seguir e resolva as questões 35 e 36:
“Catalisadores são ferramentas fundamentais para os químicos, mas os pesquisadores acreditaram por muito tempo que havia, em princípio, somente dois tipos de catalisadores disponíveis: metais e enzimas. Benjamin List e David MacMillan foram agraciados com o Prêmio Nobel de Química de 2021 porque ambos, em 2000, de forma independente, desenvolveram um terceiro tipo de catálise. Ela é chamada organocatálise assimétrica e se baseia em pequenas moléculas orgânicas. (...)
Catalisadores orgânicos têm uma estrutura estável de átomos de carbono, à qual podem ser inseridos grupos químicos mais ativos. Eles frequentemente possuem elementos comuns como oxigênio, nitrogênio, enxofre ou fósforo. (...)
A rápida expansão no uso de catalisadores orgânicos se deve principalmente a sua capacidade de conduzir catálise assimétrica. Quando moléculas estão sendo sintetizadas, geralmente ocorrem situações nas quais duas moléculas diferentes podem ser formadas, em que – assim como nossas mãos – uma é a imagem ao espelho da outra. Os químicos normalmente desejam apenas uma delas, particularmente na produção de fármacos. (...)”
Adaptado de: https://www.nobelprize.org/prizes/chemistry/2021/press-release/. Acesso em 15 Fev 22.
A respeito dos assuntos tratados no texto, são feitas as seguintes afirmativas:
I – O catalisador é uma espécie química que acelera a velocidade de uma reação química.
II – A ação de um catalisador provoca a diminuição da variação de entalpia do processo global.
III – A estrutura orgânica estável referenciada no texto pressupõe a ocorrência exclusiva de átomos de carbono quaternários.
IV – Todos os elementos químicos citados no texto são classificados como metais.
V – Dentre todos os elementos químicos citados no texto, o oxigênio é o que possui maior eletronegatividade.
Das afirmativas feitas, estão corretas apenas
Com base nessas informações, julgue o próximo item.
A lei de velocidade de reações que ocorrem em muitas
etapas é determinada pela reação global e, no caso da
degradação do ozônio, ela é igual a ν = k [O3]
2
[O2]
3
, em que
ν representa a velocidade da reação, k, a constante de
velocidade e [O3] e [O2], as concentrações em quantidade de
matéria de O3 e O2, respectivamente.
Com base nessas informações, julgue o próximo item.
A espécie O (g) é o catalisador da reação.
Com base nessas informações, julgue o próximo item.
A reação da etapa II do mecanismo proposto ocorrerá se a
energia potencial do complexo ativado for menor que a dos
reagentes.
Com base nessas informações, julgue o próximo item.
Se a taxa de produção de oxigênio (d[O2]/dt) for igual a
3,0 × 10−5 mol/s, a taxa de consumo de ozônio (d[O3]/dt)
será igual a −2,0 × 10−5 mol/s.
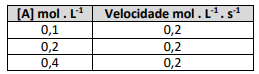
A partir das informações, a Lei de Velocidade para esta reação será de:
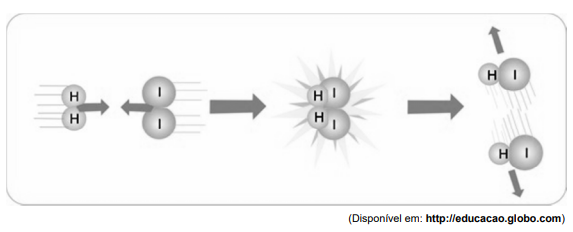
A formação do complexo ativado
N2 (g) + 3H2 (g) ⇆ 2NH3 (g) − 109,5 kJ
Nas temperaturas de 25 e 450ºC, as constantes de equilíbrio envolvendo pressão KP são 3,5.108 e 0,16, respectivamente. Considere as constantes dos gases 0,082atml/molK. Calcule o KC (constante de equilíbrio envolvendo concentração) para as temperaturas de 450 e 25°C na síntese do NH3 (g), e classifique o tipo de equilíbrio em homogêneo ou heterogêneo:
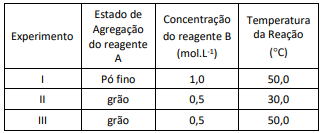
Os experimentos I, II e III, arrumados em ordem crescente de velocidade reacional, serão descritos por
A respeito de conceitos de química orgânica, julgue o próximo item.
O aumento da concentração de um dos reagentes, em uma reação química, pode aumentar a velocidade da reação.
A respeito de conceitos de química orgânica, julgue o próximo item.
A energia de ativação corresponde à energia que o sistema requer para ir dos reagentes até o estado de transição, sendo
diretamente proporcional à velocidade do processo.
S2O8 2 – (aq) + 3 I – (aq) → 2 SO4 2 – (aq) + I3 – (aq)
A tabela a seguir contém dados experimentais sobre a reação em condições específicas de temperatura e pressão.
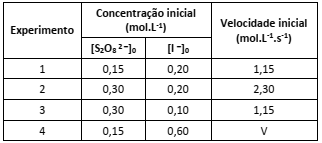
A partir das informações apresentadas é possível prever que a velocidade (V) do Experimento 4 será