Questões de Concurso
Comentadas sobre equilíbrio químico em química
Foram encontradas 933 questões
Inúmeras especIes de plantas, flores e frutas possuem substâncias coloridas em sua seiva que mudam de cor conforme o pH do meio em que estão inseridas, sugerindo que tais espécies podem atuar como indicadores ácido-base. Os indicadores são substâncias capazes de mudar de cor dependendo das características físico-químicas da solução na qual estão contidas. Em relação aos indicadores ácido-base, é correto afirmar:
Um técnico de laboratório colocou 6 mol de NO2 (g) em um recipiente, de um litro a 25° C, atingindo o seguinte equilíbrio, após um intervalo de tempo:
2 NO2 (g) ⇆ 2 NO(g)+ 02(g)
No momento do equilíbrio, notou-se que 40 % do reagente sofreu oxirredução. Neste contexto, os valores de Kc e Kp, respectivamente, são:
Em 1923, Brõnsted e Lowry propuseram que o aspecto essencial de uma reação ácido-base é a transferência de um próton de uma espécie para outra.
Dado o equilibrio: HCO3-(aq)+NH4(aq) ⇆ H2CO3(aq)+NH3(aq)
São considerados ácido conjugado e base conjugada de Brösted -Lowry, respectivamente, no equilíbrio dado acima:
A água dura existente em tubulações de caldeiras contém sais dissolvidos como o Ca(HCO3)2 e Mg(HCO3)2 que, por aquecimento, se decompõem. Por essa reação, formam-se substâncias que com o tempo diminuem a seção da tubulação, ficando aderidas nas paredes.
...
A propriedade que justifica o comportamento descrito está relacionada a:
No fenômeno de transferência de massa para uma mistura gasosa binária formada pelos gases A+B, o fluxo molar do componente A na direção z (NA, mol.s-1.m-2) pode ser calculado pela expressão:
NA=NA+NBNA. zDAB . c. ln [(NA+NBNA)−(ccA1)(NA+NBNA)−(ccA2)]
Essa equação é aplicada para difusão na direção de z com NA e NB constantes e em estado estacionário. Nesse contexto, assinale a opção CORRETA.
Na extração líquido-líquido, há a necessidade da determinação de dados de equilíbrio líquido-líquido do sistema de interesse. Um sistema interessante na área de alimentos é a desacidificação de óleos vegetais utilizando solventes orgânicos. O objetivo é utilizar um solvente líquido, como etanol, por exemplo, para retirar os ácidos graxos do óleo vegetal bruto. A figura abaixo apresenta um diagrama de equilíbrio líquido-líquido contendo óleo de girassol + solvente + ácido oleico a 25ºC, sendo que o solvente pode ser etanol puro ou misturado com água.
(Diagrama de equilíbrio líquido-líquido para o sistema contendo óleo de girassol refinado, solvente e ácido oleico a 25 ºC. Fonte: CUEVAS et al., 2010, https:// pubs.acs.org/doi/pdf/10.1021/je900791w. Acesso em 12 de janeiro de 2022.)
De acordo com a figura acima, é INCORRETO afirmar que:
A rota mais comum para a produção de etanol para consumo como cachaça (-38-48 ºGL) é por destilação em batelada. Entretanto, etanol grau alimentício (-95-96 “GL) é um importante insumo utilizado em diversas aplicações na indústria de alimentos, sendo que o processo de destilação contínua é mais indicado para produção em larga escala. A figura abaixo apresenta o diagrama de equilíbrio de fases para o sistema etanol-água.
(Diagrama T-xy para a mistura etanol e água. Fonte: https://dechema.de/en/Media/Databases.html). Acesso em 12 de janeiro de 2022.
A partir dessas informações, assinale a opção INCORRETA.
Um técnico de laboratório preparou uma solução somente com ácido acético, em uma concentração de 0,5 mol/ L. Considerando que Ka (25ºC) = 1,8 ⋅ 10-5 , qual é a concentração de H3O+, em mol/L, nessa solução em equilíbrio?
Uma solução-tampão clássica é formada pela mistura de ácido acético com acetato de sódio. Ao saber disso, um professor de química preparou uma solução-tampão com as seguintes concentrações: [CH3COOH] = 0,05 mol/L e [CH3COO-] = 0,01 mol/L. Tendo em vista log 5 = 0,7 e pKa (CH3COOH) = 4,75, o pH dessa solução é
A aspirina é um medicamento antitérmico mundialmente conhecido e, em 2022, completou 123 anos desde o seu registro. O princípio ativo deste medicamento é o ácido acetilsalicílico, que é um ácido orgânico fraco.
Considere uma solução aquosa preparada por meio da dissolução de 18,0 g de ácido acetilsalicílico (100% de pureza) em 1,0 L de água, a 25 ºC e 1 atm. A concentração de H+ nessa solução é igual a 5,70 x 10-3 mol L-1 .
Dados: log (5,7) = 0,76.
Fórmula molecular do ácido acetilsalicílico = C9H8O4
Baseado nestas informações, e considerando que a solução se encontra em equilíbrio químico, são feitas as seguintes afirmativas:
I – O valor da constante de acidez (Ka) é de 3,2 x 10-4, aproximadamente, nas condições descritas.
II – O pH da solução é aproximadamente 3,76.
III – A adição de ácido clorídrico deslocaria o equilíbrio no sentido do reagente.
IV – A adição de hidróxido de sódio à solução promoveria um aumento no valor do Ka.
Das afirmativas feitas, estão corretas apenas
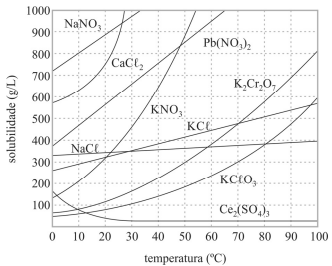
Considere-se que uma solução de nitrato de sódio (NaNO3) tenha sido preparada a 20 °C, dissolvendo-se 1,00 mol de NaNO3 em 100 mL de água, e que, posteriormente, esse sistema tenha sido resfriado a 10 °C. Nesse caso, a massa do precipitado formado é superior a 40 g.

As dissoluções dos sais apresentados no gráfico são processos endotérmicos.
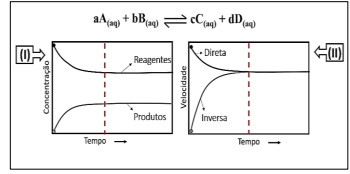
N2(g) + H2(g) ⇌ NH3(g)
Considerando, ainda, as propriedades do equilíbrio químico citado, assinale a afirmativa correta.
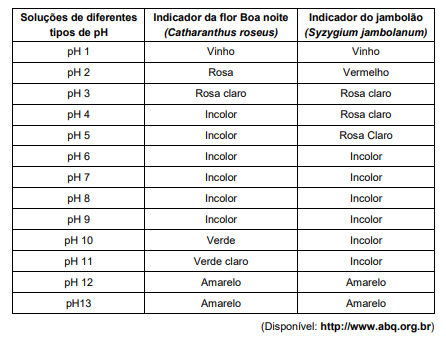
Ao testar uma solução aquosa de NaOH de concentração 0,001 mol/L observou-se as seguintes cores, respectivamente, para os indicadores de flor Boa noite e do jambolão: