Questões de Concurso
Comentadas sobre equilíbrio químico em química
Foram encontradas 606 questões
Um técnico de laboratório colocou 6 mol de NO2 (g) em um recipiente, de um litro a 25° C, atingindo o seguinte equilíbrio, após um intervalo de tempo:
2 NO2 (g) ⇆ 2 NO(g)+ 02(g)
No momento do equilíbrio, notou-se que 40 % do reagente sofreu oxirredução. Neste contexto, os valores de Kc e Kp, respectivamente, são:
Em 1923, Brõnsted e Lowry propuseram que o aspecto essencial de uma reação ácido-base é a transferência de um próton de uma espécie para outra.
Dado o equilibrio: HCO3-(aq)+NH4(aq) ⇆ H2CO3(aq)+NH3(aq)
São considerados ácido conjugado e base conjugada de Brösted -Lowry, respectivamente, no equilíbrio dado acima:
A água dura existente em tubulações de caldeiras contém sais dissolvidos como o Ca(HCO3)2 e Mg(HCO3)2 que, por aquecimento, se decompõem. Por essa reação, formam-se substâncias que com o tempo diminuem a seção da tubulação, ficando aderidas nas paredes.
...
A propriedade que justifica o comportamento descrito está relacionada a:
Na extração líquido-líquido, há a necessidade da determinação de dados de equilíbrio líquido-líquido do sistema de interesse. Um sistema interessante na área de alimentos é a desacidificação de óleos vegetais utilizando solventes orgânicos. O objetivo é utilizar um solvente líquido, como etanol, por exemplo, para retirar os ácidos graxos do óleo vegetal bruto. A figura abaixo apresenta um diagrama de equilíbrio líquido-líquido contendo óleo de girassol + solvente + ácido oleico a 25ºC, sendo que o solvente pode ser etanol puro ou misturado com água.
(Diagrama de equilíbrio líquido-líquido para o sistema contendo óleo de girassol refinado, solvente e ácido oleico a 25 ºC. Fonte: CUEVAS et al., 2010, https:// pubs.acs.org/doi/pdf/10.1021/je900791w. Acesso em 12 de janeiro de 2022.)
De acordo com a figura acima, é INCORRETO afirmar que:
A rota mais comum para a produção de etanol para consumo como cachaça (-38-48 ºGL) é por destilação em batelada. Entretanto, etanol grau alimentício (-95-96 “GL) é um importante insumo utilizado em diversas aplicações na indústria de alimentos, sendo que o processo de destilação contínua é mais indicado para produção em larga escala. A figura abaixo apresenta o diagrama de equilíbrio de fases para o sistema etanol-água.
(Diagrama T-xy para a mistura etanol e água. Fonte: https://dechema.de/en/Media/Databases.html). Acesso em 12 de janeiro de 2022.
A partir dessas informações, assinale a opção INCORRETA.
Um técnico de laboratório preparou uma solução somente com ácido acético, em uma concentração de 0,5 mol/ L. Considerando que Ka (25ºC) = 1,8 ⋅ 10-5 , qual é a concentração de H3O+, em mol/L, nessa solução em equilíbrio?
Uma solução-tampão clássica é formada pela mistura de ácido acético com acetato de sódio. Ao saber disso, um professor de química preparou uma solução-tampão com as seguintes concentrações: [CH3COOH] = 0,05 mol/L e [CH3COO-] = 0,01 mol/L. Tendo em vista log 5 = 0,7 e pKa (CH3COOH) = 4,75, o pH dessa solução é
O pH dessa solução é
Dado log 3 = 0,5
Em uma titulação de neutralização é possível a representação gráfica do ponto final da titulação (pH x
titulante). Em uma titulação de NH4OH com HCl, o gráfico que representa a curva de titulação dessa
reação é
As antocianinas e seus derivados são pigmentos naturais polares da classe de compostos orgânicos chamados flavonoides e estão presentes nas uvas, sendo responsáveis pela cor do vinho tinto. Tais pigmentos são substâncias fenólicas que podem ter diversas cores, como vermelha, roxa, azul, e podem ser encontrados também em pétalas de flores, framboesa, figo, cereja, amora, beterraba, romã, maçã, cebola roxa, repolho roxo entre outros. O extrato aquoso obtido a partir do repolho roxo tem cor roxa e pH 7, a
 , contém antocianinas e pode apresentar o
seguinte comportamento a partir da adição de gotas de
soluções aquosas de substâncias com os seguintes valores
de pH:
, contém antocianinas e pode apresentar o
seguinte comportamento a partir da adição de gotas de
soluções aquosas de substâncias com os seguintes valores
de pH: 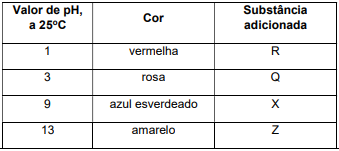
Pode-se verificar então que o extrato aquoso de repolho roxo funciona como um indicador de pH. A solução aquosa da substância R, adicionada a este extrato, pode ser de
Com referência aos conceitos de equilíbrio químico, julgue o item.
Quando um sistema atinge o equilíbrio químico, as reações químicas se cessam.
Com referência aos conceitos de equilíbrio químico, julgue o item.
No equilíbrio químico, a energia potencial do sistema é máxima.
Com referência aos conceitos de equilíbrio químico, julgue o item.
A constante de equilíbrio depende da temperatura.
No cálculo do equilíbrio químico, considera‑se as concentrações dos reagentes divididas pelas concentrações dos produtos.
Dado: Ka (HA) = 2,5.10 − 4 mol.L− 1