Questões de Concurso
Comentadas sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 232 questões

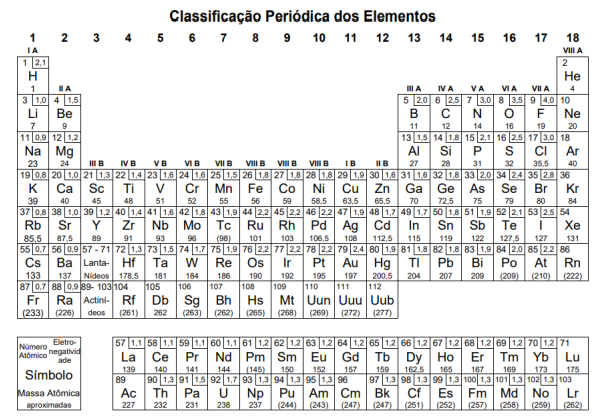
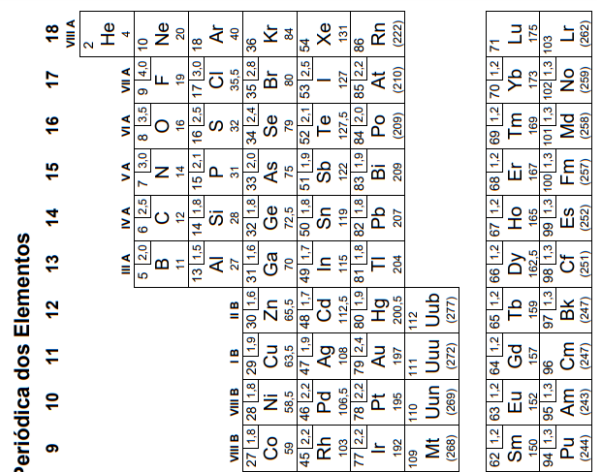
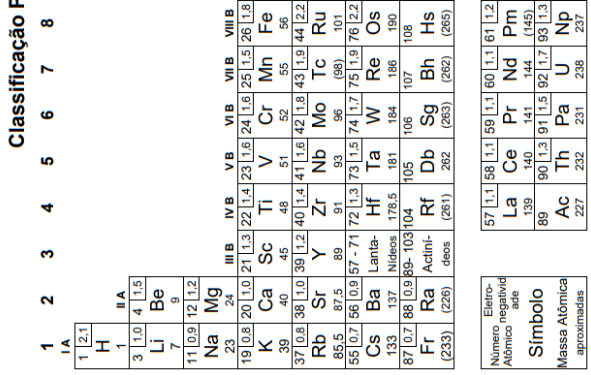
Atenção: a Tabela abaixo deve ser usada como apoio para responder a questão de Química.
10KNO3(s) + 8C(s)+ 3S(s) ➝ 5N2(g) + 6CO2(g) + 2K2CO3(s) + 3K2SO4(s)
Durante um teste envolvendo a queima de pólvora negra ao ar, foram recolhidos 75L de gás nitrogênio. Sabendo que o rendimento do processo foi de 100%, é correto afirmar que a massa de pólvora negra, em grama, usada no teste foi de
(Dado: volume molar = 25 L.mol-1 )
O elemento X é o


4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
Na segunda etapa, o óxido nítrico (NO) formado, quando exposto ao ar, se oxida rapidamente dando origem ao dióxido de nitrogênio (NO2):
2NO(g) + O2 → 2NO2(g)
Na terceira etapa, o NO2, quando dissolvido em água, forma o ácido nítrico como descrito na reação a seguir:
3NO2(g) + H2O(l) → 2HNO3(aq) + NO(g)
A quantidade máxima de ácido nítrico, em kg, que pode ser obtida a partir de 10.000 L de amônia é igual a
(Dado: volume molar = 25,0 L.mol-1)
A respeito de conceitos de química orgânica, julgue o próximo item.
O estado estequiométrico é atingido, em uma reação química, quando as concentrações de reagentes e produtos não se alteram
mais.
O número de átomos de carbono presentes na fórmula molecular do flurbiprofeno é igual a
• 2KClO3 (s) → 2 KCl (s) + 3 O2 (g) • 2 KHCO3 (s) → K2O (s) + H2O (g) + 2 CO2 (g) • K2CO3 (s) → K2O (s) + CO2 (g)
Nas condições reacionais empregadas, o rendimento foi de 100% e produziu 1,80 g de água, 19,2 g de gás oxigênio e 22,0 g de gás carbônico.
Os percentuais aproximados de KClO3, KHCO3 e K2CO3 na amostra inicial são, respectivamente, iguais a
Em uma reação de neutralização, o reagente consumido em primeiro lugar é chamado de reagente limitante. A quantidade mínima de produto que pode ser formada depende da quantidade inicial desse reagente; o reagente presente em quantidade superior à necessária para reagir é chamado de reagente em excesso. Esse tipo de reagente em quantidade superior é totalmente utilizado pela reação, de modo que é inteiramente consumido.

Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item.
Assumindo-se que todo o monóxido de carbono
foi consumido na conversão da hematita para o ferro
e que essa reação foi completa e sabendo-se que
MFe = 56 g/mol e M(Fe2O3) = 160 g/mol, é correto
concluir que a quantidade, em gramas (g), de ferro
obtida a partir de 0,48 kg de Fe2O3 é superior a 400.
Com base nessa situação e considerando-se
 a massa molar da cafeína e
a massa molar da cafeína e  a constante de Avogadro, é correto concluir
que o número de moléculas de cafeína ingeridas pelo britânico é
a constante de Avogadro, é correto concluir
que o número de moléculas de cafeína ingeridas pelo britânico é 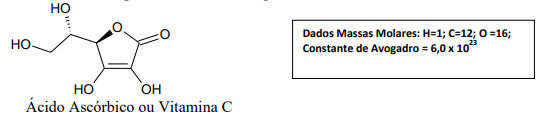
Assinale a alternativa que apresenta corretamente a quantidade de matéria, em mols, e a quantidade de oxigênio, em miligramas, presentes em 440 mg de ácido ascórbico.
Qual a massa de CO2, em gramas, produzida na combustão completa de 370 mg de varfarina?
Dado: massa molecular da varfarina = 308 g mol-1 massa molecular do CO2 = 44 g mol-1
SO3(g) +H2SO4(l) → H2 S2 O7(l) (Equação1) H2S2O7(l) + H2O(l) → 2H2 SO4(l) (Equação2)
CAMPOS, R. V. Ácico Sulfúrico. Rev. Virtual Quim. 2011, 3(3), 210-214 (adaptado).
Para a produção do ácido sulfúrico 98% m/m, a indústria partiu de 800kg de SO3 e 980kg de H2SO4, além de água o suficiente para obtenção desse produto. A massa de ácido sulfúrico 98% m/m que se pode obter, em kg, é
Dados: Massa molar: O=16g/mol; H=1g/mol; S=32g/mol
Dados: MMFe = 56 g mol-1 MMO = 16 g mol-1
O processo de obtenção consiste na calcinação da mistura de sílica (SiO2) com carbonato de sódio (Na2CO3), produzindo o silicato de sódio e gás carbônico. Este processo apresenta rendimento de 70%.
A massa de silicato de sódio que poderá ser obtida por este processo, a partir de 3,0 kg de sílica, é: Dados: Massas molares em g.mol–1 Si = 28; O = 16; Na = 23; C = 12.
O oxigênio representa aproximadamente 20% (em volume) do ar atmosférico em relação aos outros gases presentes na mistura. Quando o oxigênio e o monóxido de carbono se encontram, ocorre a seguinte reação química.
CO (g) + ½ O2 (g) → CO2 (g)
Nessa situação, considerando que todos os gases estejam submetidos à mesma pressão e temperatura, o volume de ar necessário para a combustão completa de 20 L de monóxido de carbono é
Acerca de estequiometria, julgue o item que se segue.
As bases fundamentais da estequiometria são a lei das
proporções definidas, a lei das proporções múltiplas e a lei
das proporções equivalentes.
Acerca de estequiometria, julgue o item que se segue.
Em uma reação química, o reagente limitante serve de base
para o cálculo do rendimento teórico.
A partir desses dados, a perita conseguiu determinar a fórmula empírica como sendo:
Por exemplo, pode-se produzir 448cm3 de H2 nas CNTP reagindo alumínio (peso molecular de 27g) com excesso de uma solução aquosa de HCl, desde que seja usada a seguinte quantidade de átomos de alumínio: