Questões de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria. para Concurso
Foram encontradas 964 questões
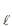 ) e 1,0 mol de amônia (NH3 ). Esses gases reagem (ver reação abaixo) com um rendimento de 80%.
) e 1,0 mol de amônia (NH3 ). Esses gases reagem (ver reação abaixo) com um rendimento de 80%.HC
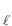 (g) + NH3(g) ? NH4 C
(g) + NH3(g) ? NH4 C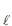 (s)
(s)Considerando-se a pressão de vapor do NH4 C
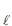 insignificante e o comportamento ideal para os gases, a pressão total, em atm, no reator, após a reação, é
insignificante e o comportamento ideal para os gases, a pressão total, em atm, no reator, após a reação, éDado: R = 0,082 atm · L · mol -1· K-1
A concentração da espécie MnO4- , em mol/L, nessa solução, é
Dado: M(KMnO4 ) = 158 g/mol
A massa de NaOH, em g, que deve ser utilizada para neutralizar todo o ácido sem que haja excesso de base é
Dados:
M(KOH) = 56 g/mol
M(NaOH) = 40 g/mol
AgNO3 (aq) + KI (aq) ? AgI (s) + KNO3 (aq)
Levando-se em conta a estequiometria da reação e o conceito de reagente limitante, e sendo as massas molares do AgNO3 = 170 g/mol e do KI = 166 g/mol, após a reação
Considerando os limites desse método e os resultados experimentais dessa análise, a concentração em g/L, de NaCl na amostra é
Dado: M(NaCl) = 58.5 g/mol