Questões de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria. para Concurso
Foram encontradas 964 questões
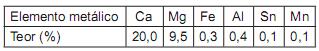
Um recurso empregado para controlar a emissão de poluentes consiste na adição de calcário ao leito fluidizado em que se queimam carvões contendo enxofre. Considerando-se o uso de um calcário dolomítico com a composição indicada acima, qual a quantidade estequiométrica, em kg, a ser utilizada por tonelada de carvão no caso de um combustível com 1,6% de enxofre (S)?
Dado: Leve em conta apenas o óxido de cálcio na eficiência do processo.
Calcule a variação da entalpia (ΔH) para a reação global de formação de 0,325 ton calcita a partir de seus elementos constituintes utilizando as reações e os dados termodinâmicos fornecidos a seguir.
Use: Massa molar O = 16 g.mol-1,
I) C(s) + O2(g) ➔ CO2(g) ∆ H = -393,5 kJ mol-1
II) CaO(s) ➔ Ca(s) + 1/2O2(g) ∆H = +635,0 kJ mol-1
III) CaO(s) + CO2(g) ➔ CaCO3(s) ∆H = -178,3 kJ mol-1