Questões de Concurso
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 961 questões
Considerando as informações acima e que os desvios padrão sejam
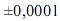 g, para uma simples leitura na balança utilizada,
g, para uma simples leitura na balança utilizada,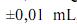 e , para uma leitura de menisco no balão, julgue os próximos itens.
e , para uma leitura de menisco no balão, julgue os próximos itens.Caso a solução de biftalato preparada seja usada, posteriormente, na padronização de uma solução básica, a presença de impurezas no biftalato usado para a preparação de sua solução gerará um erro aleatório que, consequentemente, afetará a precisão dos resultados obtidos durante a padronização.
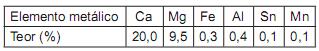
Um recurso empregado para controlar a emissão de poluentes consiste na adição de calcário ao leito fluidizado em que se queimam carvões contendo enxofre. Considerando-se o uso de um calcário dolomítico com a composição indicada acima, qual a quantidade estequiométrica, em kg, a ser utilizada por tonelada de carvão no caso de um combustível com 1,6% de enxofre (S)?
Dado: Leve em conta apenas o óxido de cálcio na eficiência do processo.
Calcule a variação da entalpia (ΔH) para a reação global de formação de 0,325 ton calcita a partir de seus elementos constituintes utilizando as reações e os dados termodinâmicos fornecidos a seguir.
Use: Massa molar O = 16 g.mol-1,
I) C(s) + O2(g) ➔ CO2(g) ∆ H = -393,5 kJ mol-1
II) CaO(s) ➔ Ca(s) + 1/2O2(g) ∆H = +635,0 kJ mol-1
III) CaO(s) + CO2(g) ➔ CaCO3(s) ∆H = -178,3 kJ mol-1
Ni(s) + CO(g) → Ni(CO)4(g)
Considerando as massas molares, em g/mol, do Ni = 59, C = 12 e O = 16, qual a massa de Ni(CO)4 obtida, em kg, aproximadamente, dado que 20 kg de níquel metálico foram volatilizados?
Dados eventualmente necessários: massas molares (g/mol): A = 23; C = 12; O = 16; Cl = 35,5; H = 1.
Considerando a formação do metano, a partir da reação:
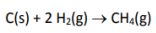
Assinale a alternativa que apresenta qual seria a quantidade em quilocalorias, em valor absoluto, envolvido na formação de 1 mol de metano dadas as seguintes variações de entalpia de combustão:
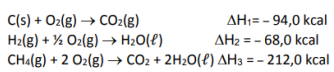
Assinale a alternativa correta.
IO3− + I− + H+ ⇌ I2 + H2O
Os menores coeficientes estequiométricos inteiros que balanceiam essa reação são, nessa ordem,
Nessa situação, as concentrações, em mol L-1 , remanescentes de brometo e iodeto dissolvidos em solução seriam, respectivamente,
Dado: Kps(AgBr) = 5 x 10-13 Kps(AgI) = 5 x 10-17
Considere a tabela abaixo para responder a questão 60:
Analise as afirmativas abaixo e assinale a alternativa em que a obtenção do ferro a partir da hematita pode ser descrita pela equação: Fe2O3 + 3CO → 2Fe + 3CO2 .
I. A massa de ferro que será obtida a partir de 0,04 mol de óxido férrico é 4,48 g.
II. A quantidade de CO necessários para produzir 7 mol de ferro é 10,5 mol.
III. A massa de gás carbônico obtida partindo-se de 20 kg de óxido de ferro III será 16,5 g.
IV. A quantidade de monóxido de carbono necessária para reagir com 600 g de óxido férrico é 11,25 mol.
V. O volume de CO, medidos nas CNTP, consumido na obtenção de 60 kg de ferro será ~3,6 104 L.
Após analisar as afirmativas de I a V, assinale a
alternativa correta:
MnO4- (aq) + Fe2+(aq) + H+(aq) → Fe3+(aq) + Mn2+(aq) + H2O(l)
Para a produção do composto 1-bromobutano a partir do 1-butanol, uma parte dos átomos dos reagentes é desperdiçada, ou seja, não é incorporada aos produtos. Baseado no conceito de economia de átomos, assinale a alternativa que representa o valor de quanto seria, em termos de percentual, a quantidade de massa desperdiçada, dada a reação abaixo.
H3C – CH2 – CH2 – CH2 – OH + NaBr + H2SO4 → H3C – CH2 – CH2 – CH2 – Br + NaHSO4 +H2O
O resultado da análise de combustão de 2,5g de um composto mostrou possuir somente Carbono (C), Hidrogênio (H) e Oxigênio (O). As massas de água e dióxido de carbono obtidos foram 9 e 4,4g, respectivamente. Admita que a razão molar para produção de CO2 é 1 mol de C ~ 1 mol de CO2; e para a produção de H2O é 1 mol de H2O ~2 mols de H. A partir da dedução da fórmula empírica do reagente da seguinte equação: CxHyOz → CO2 + H2O, assinale o resultado obtido.
Dados: CO2: 44 g/mol; H: 1 g/mol; C: 12 g/mol; H2O: 18 g/mol).