Questões de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria. para Concurso
Foram encontradas 961 questões
Se essa reação for reproduzida em laboratório utilizando 0,98 g de ácido sulfúrico, e sabendo-se que as massas atômicas, em g/mol, são:
Na = 23, Cl = 35,45, S = 32,06, O = 16 e H = 1, as massas de ácido clorídrico e sulfato de sódio obtidas são, respectivamente,
No pré-tratamento de material lignocelulósico por via ácida
empregando ácido sulfúrico, foram obtidos 200 m3 de
hidrolisado rico em pentoses. A concentração de ácido sul-
fúrico neste hidrolisado é igual a 2 x 10-2 mol/L. Visando a
aproveitar esse hidrolisado para a produção de etanol de
segunda geração a partir da fermentação das pentoses,
foi feito um tratamento por overliming, tendo sido utilizado
óxido de cálcio e empregando-se 25% de excesso deste
em relação à quantidade estequiométrica necessária para
a neutralização.
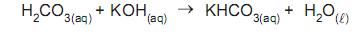
A fórmula estrutural do ácido carbônico é
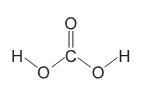
Na reação total, o sal formado e a proporção de reação do ácido com a base são, respectivamente,
6Fe2+(aq) + Cr2O72-(aq) + 14H+(aq) ? 6Fe3+(aq) + 2Cr3+(aq) + 7H2O(L)
Qual é a percentagem em massa de ferro na amostra?
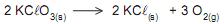
Sendo o volume molar igual 22,4 L/mol (na condição normal de temperatura e pressão), o volume máximo de oxigênio que pode ser obtido a partir da decomposição de 4,00 mol de KCLO3 , com o rendimento percentual de 90%, em L, é
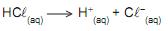
O volume, em mL, de solução aquosa de HCL0,1 mol/L necessário para o preparo de 1 L de solução com pH = 3 é
No meio aquoso, esses dois sais reagem instantaneamente, de acordo com a equação balanceada abaixo, e nela se forma um sal muito pouco solúvel.

A quantidade máxima, em gramas, de AgCL sólido (massa molar = 143,5 g/mol e Kps = 10-10 ) que se forma é de, aproximadamente,

Se, no frasco Erlenmeyer, há 25,00 mL de HCL(aq) 0,200 mol/L, o volume de NaOH(aq) 0,100 mol/L que deve escoar da bureta, em mL, até se atingir o ponto estequiométrico, é

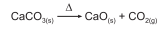
A quantidade máxima, em kg, de óxido de cálcio que se obtém a partir de 200 kg de calcário, contendo 90% em massa de carbonato de cálcio, é
Considere a hipótese de reação, unicamente na direção do produto, entre 5 mol de nitrogênio gasoso e quantidade suficiente de hidrogênio gasoso para o consumo total do N2 e formação de gás amoníaco, conforme a equação a seguir.
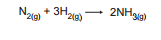
O volume máximo de NH3(g) , em litros, a ser obtido na CNTP é

A charge faz uma critica às exigências de controle de qualidade para a certificação em produtos. Nessa perspectiva, considere que a massa desse projétil é 1,5 g. Logo, a massa de prata presente, em gramas, é aproximadamente

